瘤声机| 浙江大学医学院附属第二医院妇科学术交流会
我们在认为是子宫肌瘤的情况下手术,但术后病理结果是子宫肉瘤,如果术前能预先知道它是子宫肉瘤几率大,我们会有一定的相应处理。子宫平滑肌瘤和肉瘤变,我们术前是否是比较好的方法进行评估?对于子宫平滑肌肉瘤,目前有哪些治疗方式?
一、子宫平滑肌瘤(ULM)VS子宫平滑肌肉瘤(ULMS)
- 1.子宫肉瘤
子宫肉瘤约占女性生殖道恶性肿瘤的1%,子宫体恶性肿瘤3-7%,其病因尚不明确;
他莫昔芬可使子宫肉瘤的发病风险增加3倍;
盆腔放射治疗远期继发子宫肉瘤可能性升高;
影像学检查在术前难于鉴别,通常病理检查确诊;
肿瘤分期是子宫肉瘤最重要的预后因素;
目前尚未达成最佳治疗方案。
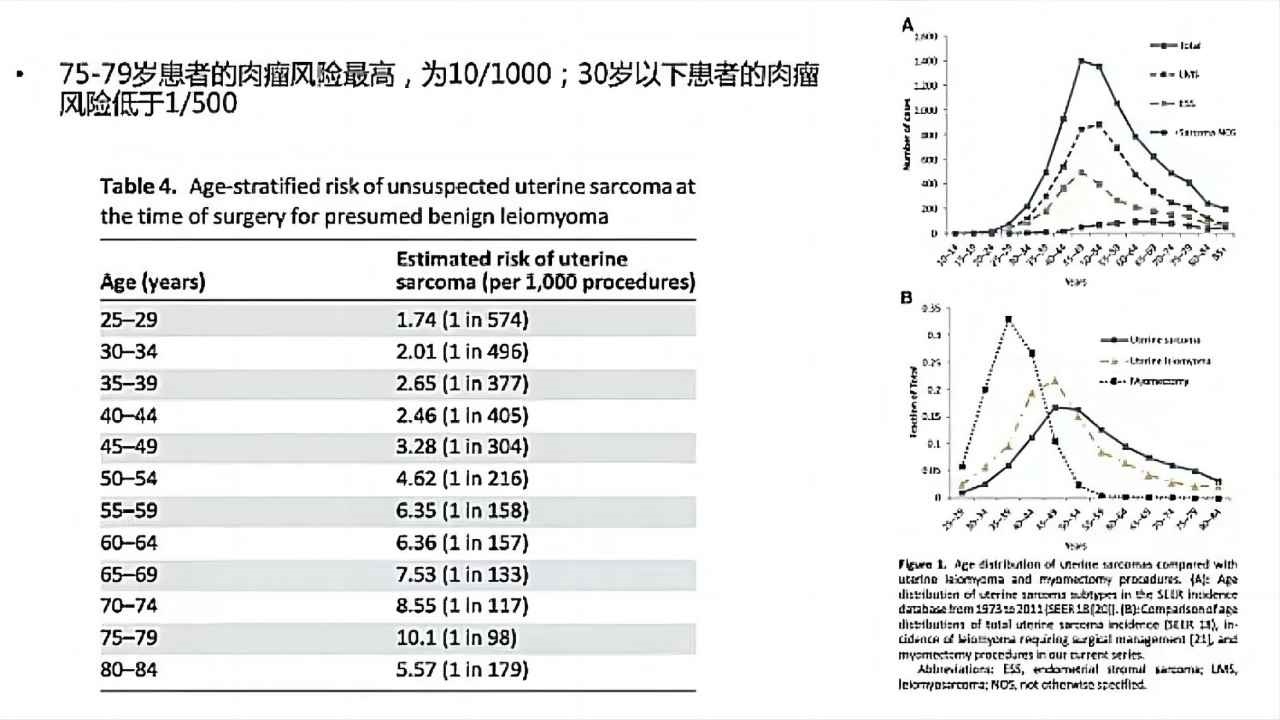
(图4)TheOncologist(2015)
上图为2015年Oncologist发表的关于子宫肉瘤的流行病学调查,随着年龄的增高,在绝经后或者老年人有子宫肌瘤,它发生肉瘤变的风险会更高,这是流行病学告诉我们的一个可能的趋势。(图4)中的两张趋势图,整体来说,在50岁以上(围绝经期时)为比较高的峰值,绝经后子宫肌瘤增大是一个重要的风险因素。
子宫肉瘤是一类恶性间叶组织来源肿瘤,病理学类型与治疗方案选择与预后密切相关。
子宫平滑肌肉瘤:40-50%;
子宫内膜间质肉瘤:低级别、高级别;
未分化子宫肉瘤;
其他类型:子宫腺肉瘤血管周上皮样细胞肿瘤、横纹肌肉瘤。
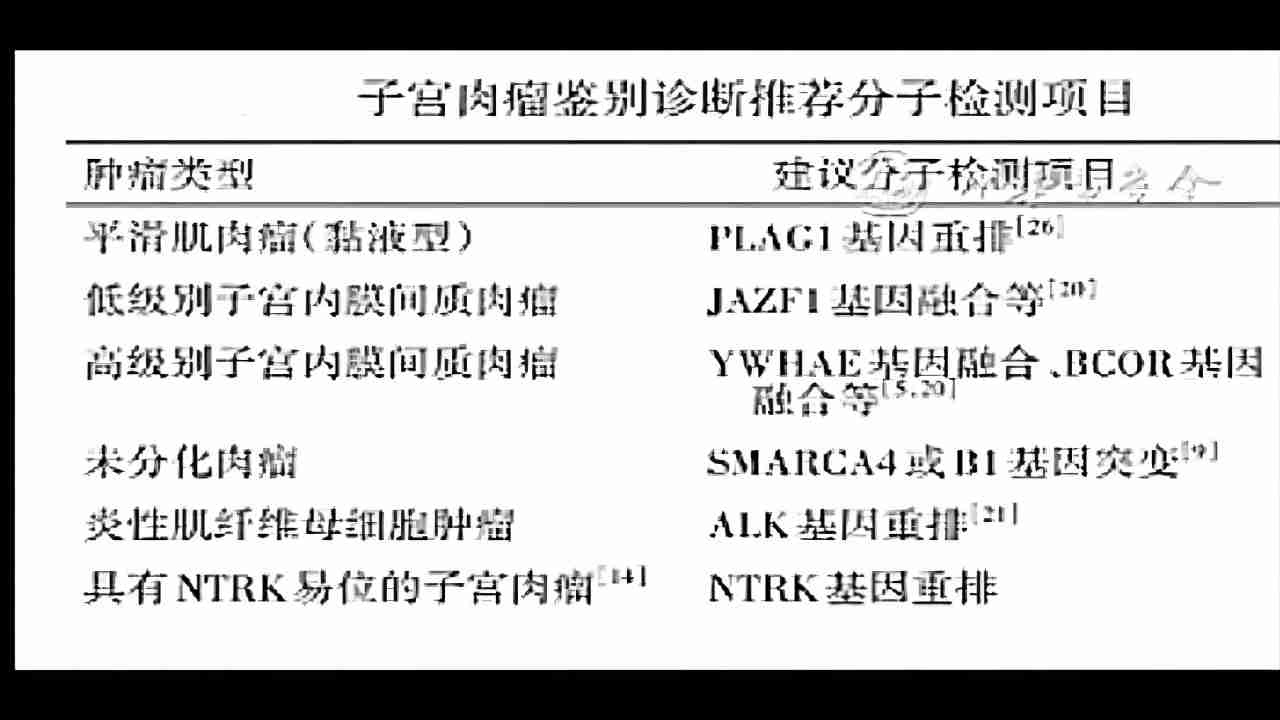
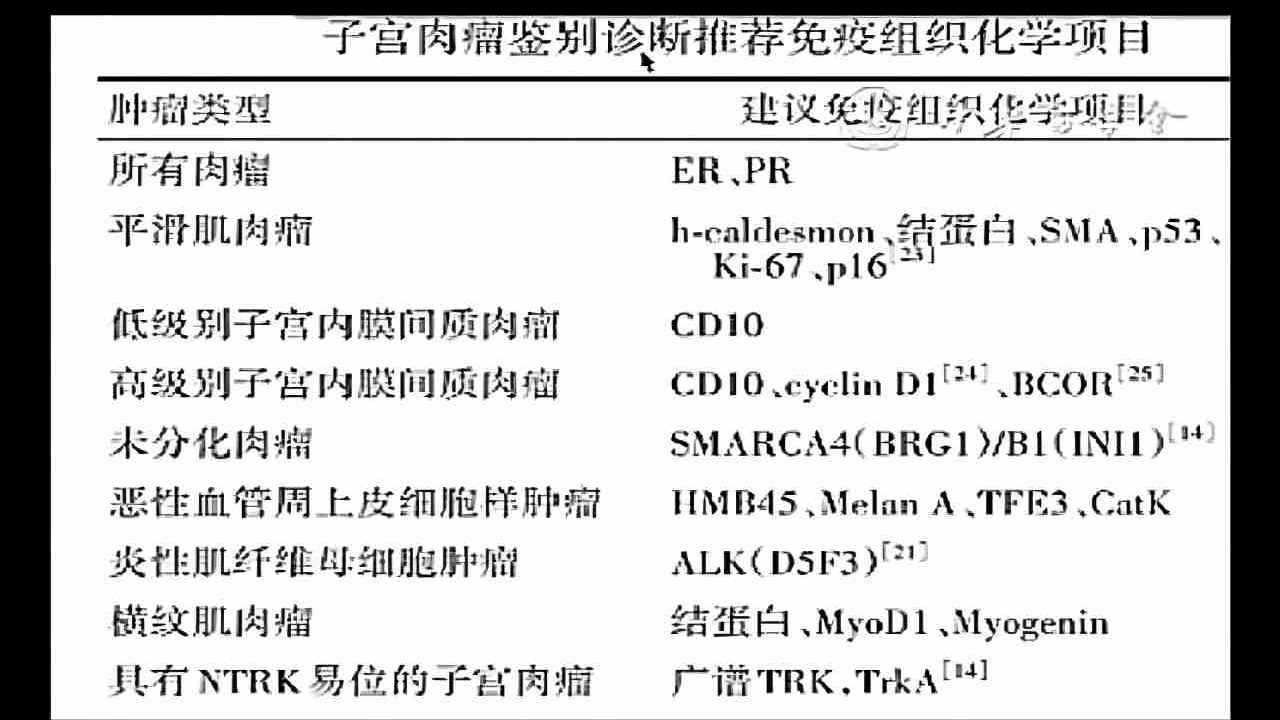
(图5)中华医学会(2021)推荐子宫肉瘤鉴别项目
所有肉瘤都要做ER、PR免疫检测,子宫肉瘤的鉴别除了免疫组织化学项目以外还会推荐分子检测项目,卵巢癌和软组织肉瘤都会去做这个检查,特别对一些罕见类型的子宫肉瘤的鉴别诊断用。

(图6)根据FIGO分期标准(2009)进行子宫平滑肌肉瘤的分期
子宫肉瘤的预后和临床分期是密切相关的,根据肿瘤的大小,是否超出子宫局限盆腔,是否侵犯附件,是否侵犯其他盆腔组织,是否转移到盆腔外等进行分期。
诊断:
子宫肉瘤缺乏特异性床表现;
短期明显增大子宫平滑肌瘤需引起重视;
诊断性刮宫或子宫内膜活检敏感性差;
影像学B超、CT、MRI、PET/CT术前难分辨;
MRI+DW有助于定位及定性。
- 2.子宫平滑肌肉瘤(ULMS)诊断
诊断(ULMS)临床表现:
最常见的子宫肉瘤亚型,症状与体征与子宫平滑肌瘤相似,术前难以区别;多见于40岁以上女性,围绝经期是高峰期;异常阴道出血(56%)、可触及的盆腔肿块(54%)和/或盆腔疼痛(22%)。
子宫平滑肌瘤vs子宫平滑肌肉瘤:
800:1;平滑肌瘤短期内增大(6个月増大1倍);未使用激素替代治疗的绝经后女性,子宫平滑肌瘤持续增大应怀疑恶性。
诊断(ULMS)辅助检查:
影像学检查:彩色多普勒超声检查、胸腹盆腔CT/MRI,必要时PET-CT。
病理学检查:诊断行刮宫,术中怀疑恶性可能快速切片病理学检查;术后确诊做ER/PR监测。
uLMP的鉴别诊断:富于细胞性平滑肌瘤、不典型平滑肌瘤、上皮样平滑肌瘤以及恶性潜能未定平滑肌瘤。
其他:X线、CTU、膀胱镜、胃肠镜等。
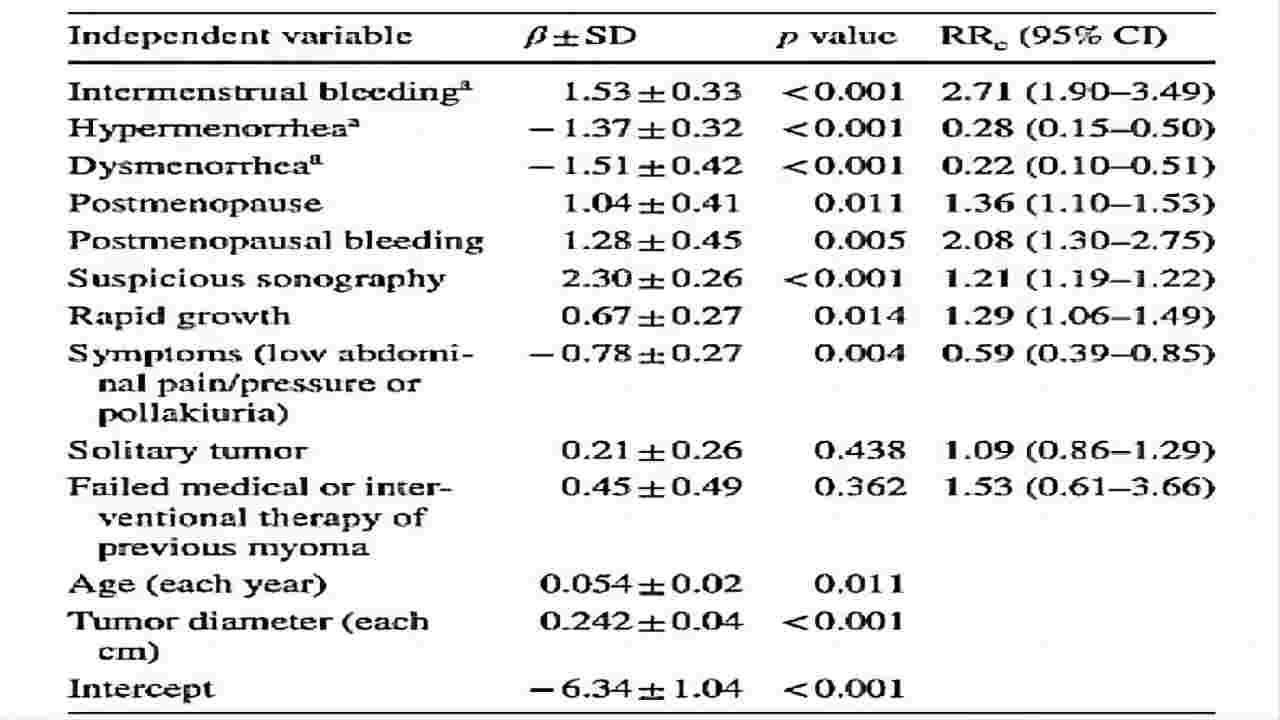
(图7)TheOncologist(2019)数据对比分析
鉴别?﹣临床症状
目前为止无明确有助于区分ULMS和ULM的具体症状或迹象。
常见症状:子宫出血、可触及的盆腔肿块、盆腔疼痛等;术前ULMS风险评分,注意出血症状经间出血:月经过多、痛经、绝经后出血、快速增长。
肿瘤快速生长是其最重要的特征之一,但快速生长的子宫肿瘤患者的子宫肉瘤,如ULMS的发生率与非快速生长的子宫肿瘤患者相比,并没有显著升高0.7%vs0.23%,概率较低;
大多数ULMS是在术后诊断的。
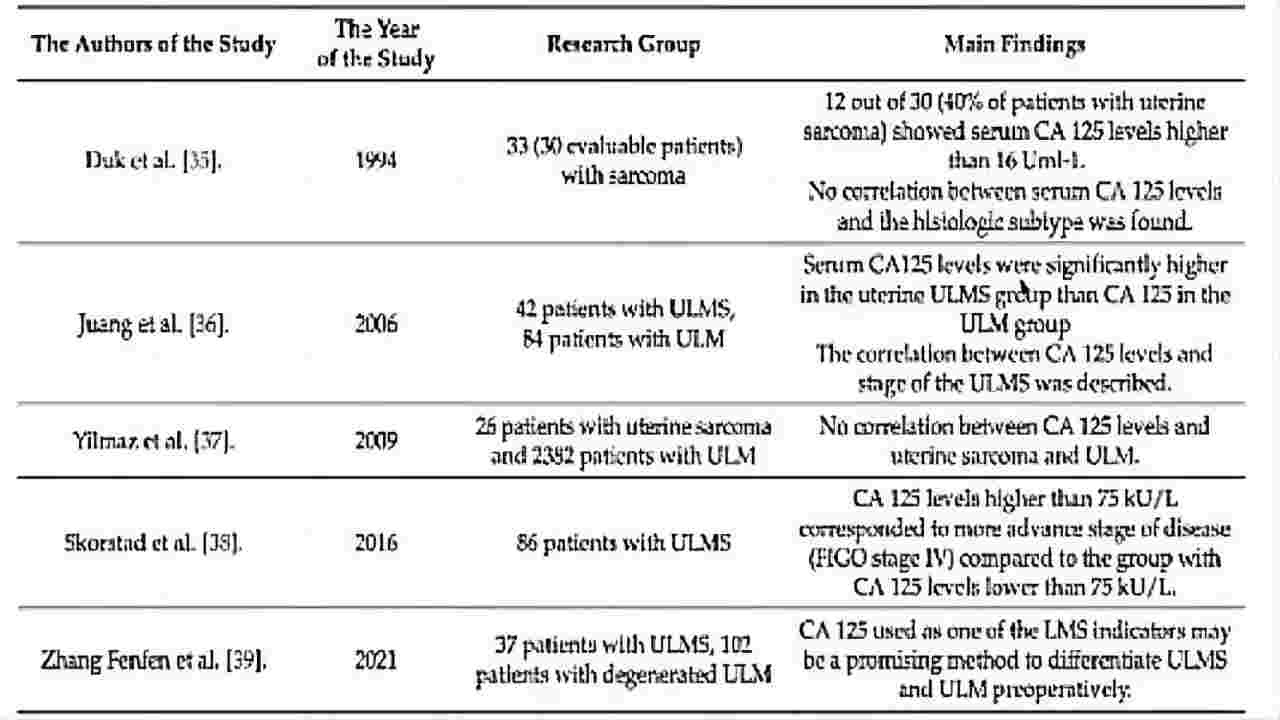
(图8)Cancers(2022)平滑肌瘤和平滑肌肉瘤鉴别
Duk等发现40%子宫肉瘤患者治疗前ca125水平升高,但ca125水平与组织学亚型(包括ULMS)无关;
Skorstad等发现较高水平的ca125与疾病晚期相关;
张芬芬等评估了CA125作为ULMS的指标之一的有效性,其水平与乳酸脱氢酶(LDH)和人附睾蛋白4(HE4)水平相关;
单独CA125在区分ULM和ULMS没有用;
CA125可以与其他指标结合HE4、LDH、血液参数和或病变图像,提高敏感性、特异性和准确性。
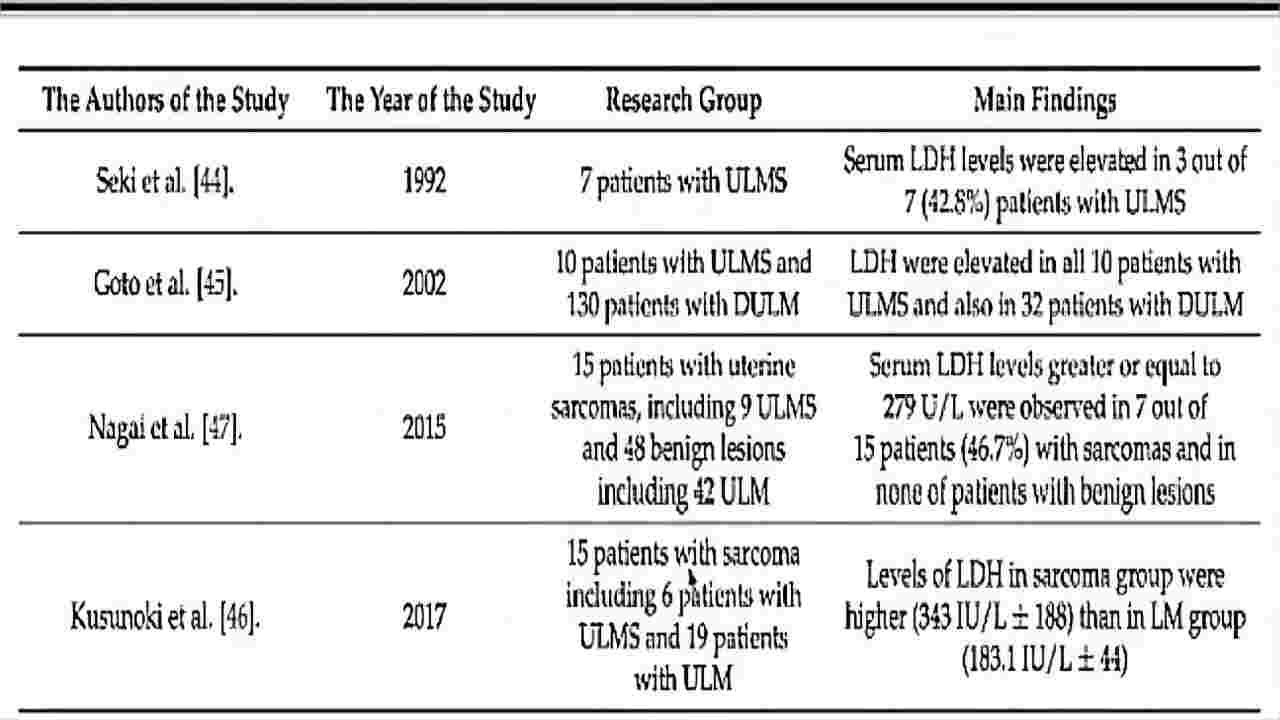
(图9)Cancers(2022)乳酸脱氢酶鉴别诊断
单独乳酸脱氢酶(LDH)检测,不被作为ULM和ULMS诊断的有效指标。CEA、CA19-9和CA15-3尚未用于LM和ULMS的鉴别。乳酸脱氢酶是一种在糖酵解途径末端催化乳酸转化为丙酮酸的酶,许多癌症包括肝细胞癌(HCC)、乳腺癌等。
LDH与肿瘤的生长、维持和侵袭有关;Seki等发现ULMS患者中有42.8%血清LDH水平异常升高。LDH水平的升高可能有助于ULMS和ULM分化。
Nishigaya等人将LDH水平与d﹣二聚体和c反应蛋白(CRP)并列;张芬芬等人将CA125和HE4并列;张国儒等认为LDH≥193U/L具有统计学意义。
总体来说,单独LDH检测不作为子宫平滑肌瘤和子宫平滑肌肉瘤的诊断标准。
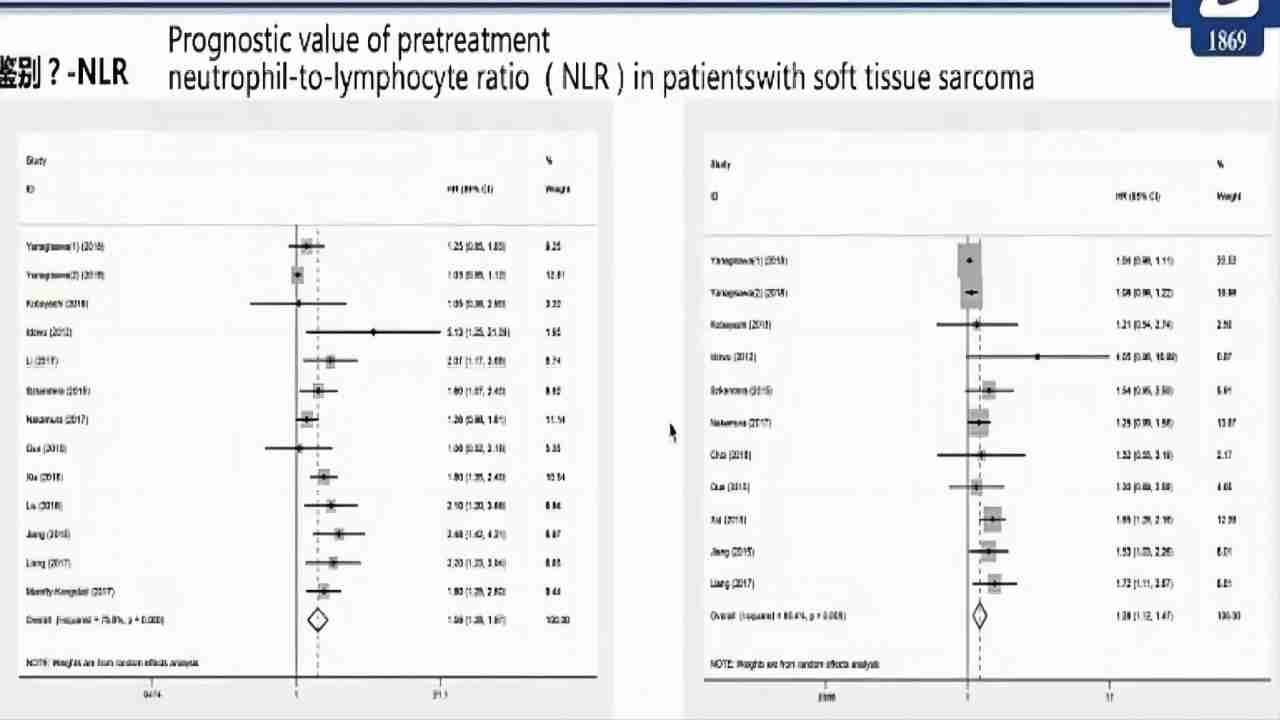
(图10)Liuetal.Medicine(2018)中性粒细胞与淋巴细胞比率鉴别诊断
分析2820名患者,NLR升高与OS显著相关[HR:1.59,P<0.001],DFS/PFS(HR=1.28;P5厘米)、肿瘤深度(深)、等级(G3)、TNM分期(III-IV)相关。

(图11)Cancers(2022)超声和CT鉴别
超声:ULM与ULMS的成像非常相似--椭圆形不均匀大肿块,扭曲子宫结构,伴有坏死和出血区域;ULMS多为实性,回声不均匀;肿瘤边界不规则。超声在鉴别ULM和ULMS方面的应用有限。
CT:CT对子宫肿块的术前诊断、分期和鉴别诊断作用有限。增强后肉瘤表现为较大、稍不均匀的肿块,强化明显,周围坏死较早,与超声表现相似。Lee等人认为钙化可能有助于平滑肌瘤肿瘤的诊断,目前没有关于ULM或ULMS子宫钙化频率的研究发表。CT在确定疾病的分期方面有一定的价值。在子宫切除术后并发症的评估方面也有一定的价值,目前尚无资料证明其在ULMS及ULM鉴别方面的价值。
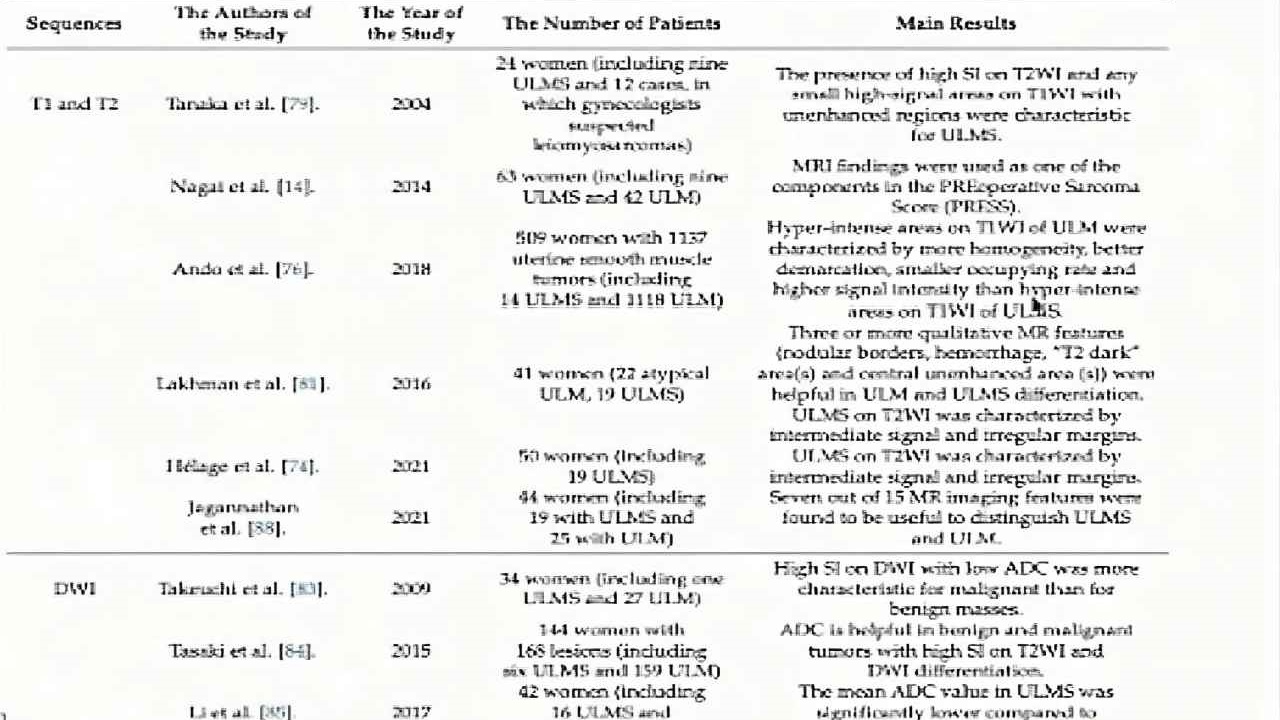
(图12)Cancers(2022)MRI鉴别
Helage等将MRI图像上恶性病变分为两种类型:1型:腔内病变(如子宫内膜间质肉瘤);2型:以子宫动脉粥样硬化(ULMS)为例。ULMS组的特点是边缘不规则和肿瘤异质性;肉瘤的一个显着特征是高信号强度(SI)。
在T2WI上,高信号提示子宫肉瘤细胞密度高或血管密度高。在t1加权像(T1WI)上,高信号提示肿瘤内出血和凝固性坏死,也提示子宫肉瘤。T1WI高信号与ULMS和ULM区分更相关,T2WI高强度显示恶性病变更典型弥散加权成像(diffusion-weightedimaging.DWI)以水分子的扩散运动为基础来揭示组织特征;肿瘤组织的表观扩散系数(ADC)是水组织的2-3倍,恶性肿瘤的表观扩散系数低于正常组织。
Takeuchi视察到,包括ULMS在内的恶性肿瘤DWI高SI,ADC明显低于良性病变;
DW联合T2WI诊断教感性最高,特异性最高。
在所有方法中,DWI,尤其是DWI与T2WI结合ADC评估是区分ULM和ULMS最有效、最精确的方法。
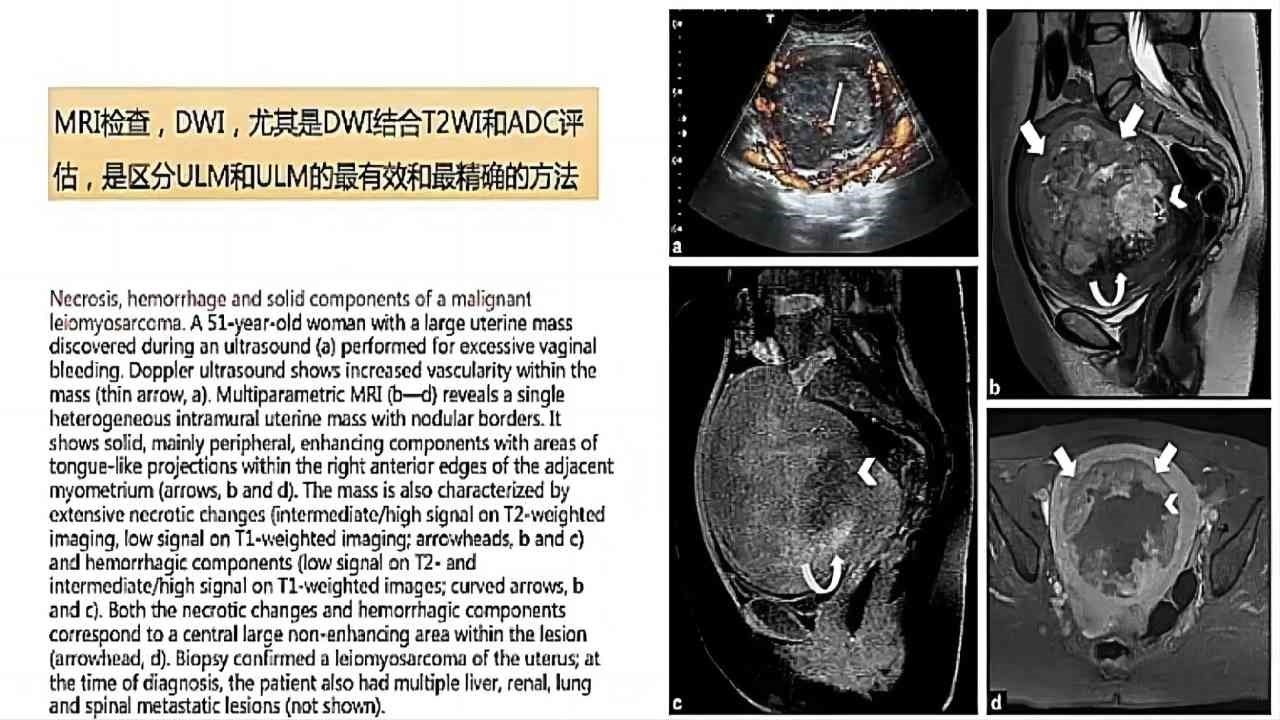
(图13)Cancers(2022)文献资料及检查图像①
子宫平滑肌瘤,主要是子宫动脉粥样硬化引起的,周边血管强化会稍明显,环状绕边血流在超声上也可以看到,肿瘤的异质性会更多,磁共振可以看到肿瘤的不同的坏死表现。
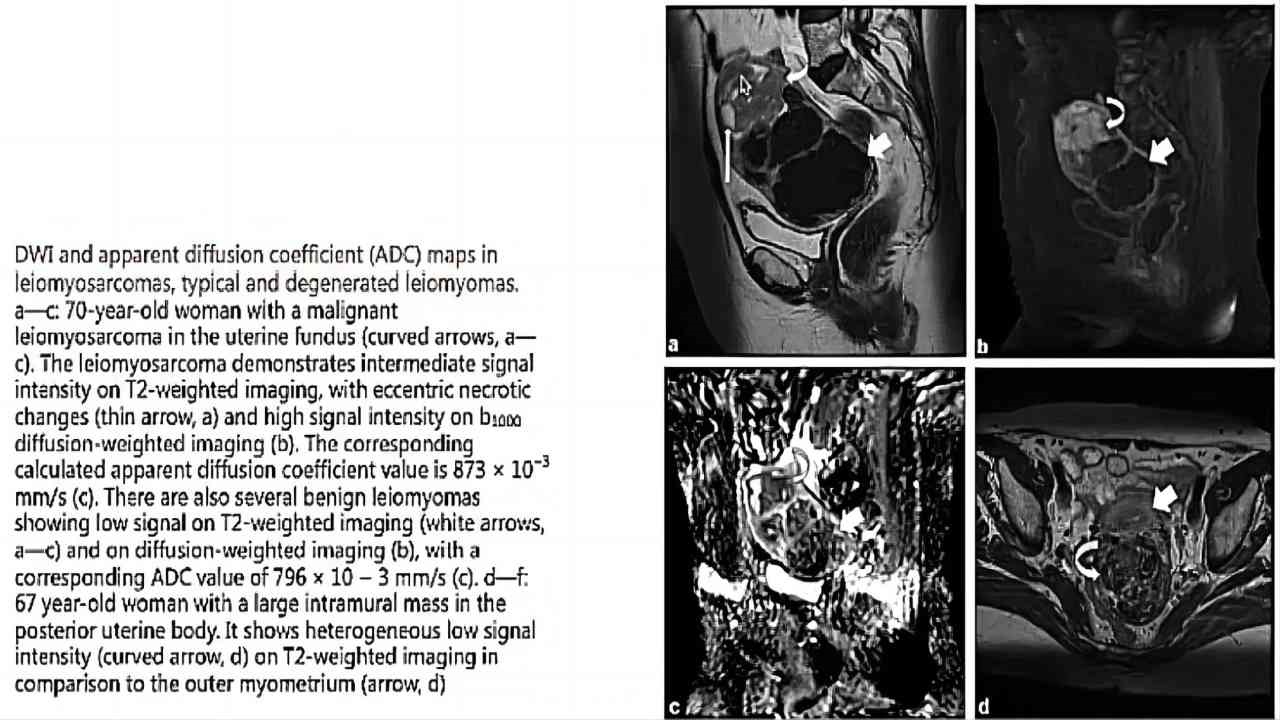
(图14)Cancers(2022)文献资料及检查图像②
磁共振下肿瘤的异质性的表现,T2项比较高的信号。
PET-CT:恶性肿瘤细胞转化的最具特征的生化标志之一是葡萄糖转运的加速速率。Nagamatsu等人估计PET-CT对LMS诊断的诊断准确率为73%。PET似乎是一种检测和定位子宫肉瘤复发的准确方法。目前分析PET-CT在子宫肉瘤早期分期中的作用的研究还很少,PET-CT可能是一种更好的诊断子宫肿物方法,在患者的随访中发现转移。
AI:使用机器学习模型是否有助于肿瘤分化,特别是对于罕见的肿瘤分化;目前还没有足够的证据表明使用放射组学诊断子宫肉瘤的好处;人工智能的发展是我们这个时代的主要目标之一;未来它可能是LM和LMS分化的最好方法之一。
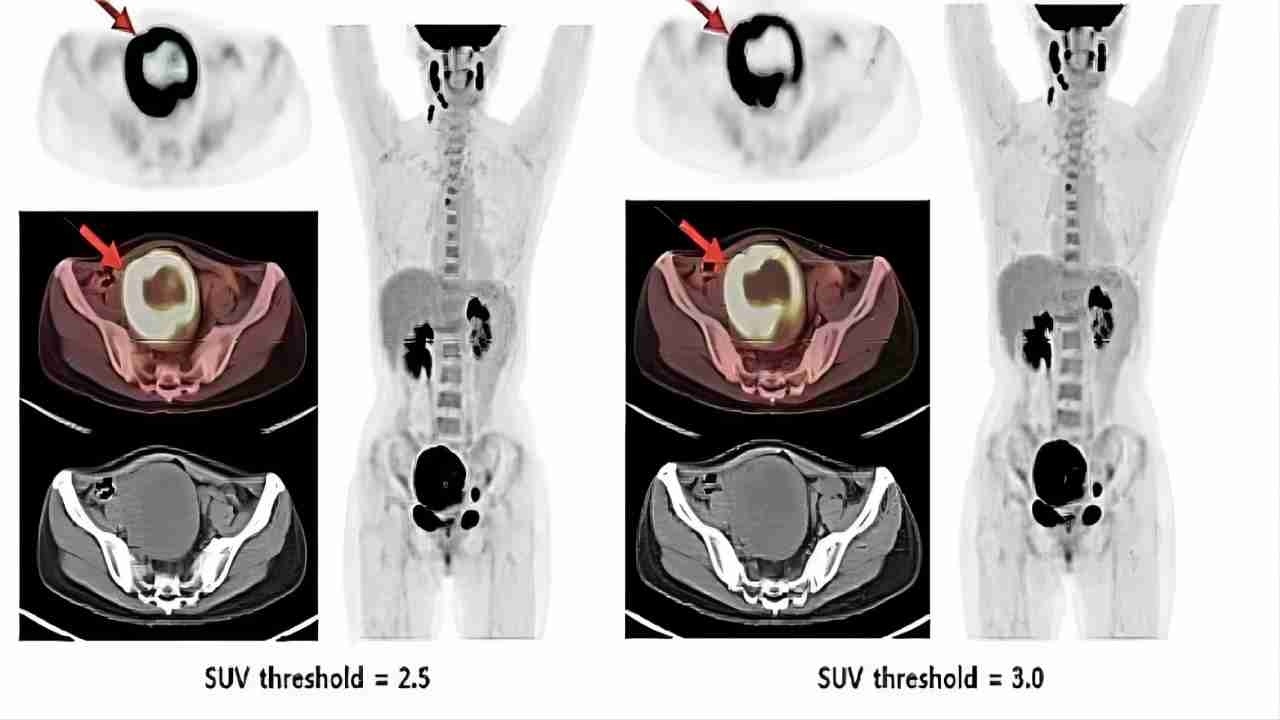
图15)PEC-CT成像
PEC-CT对于ULM和ULM的鉴别没有发现有意义PET显示出更好的盆腔外转移检测;在肉瘤患者的随访中,PET在复发性子宫ULM中尤其重要。

(图16)EuropeanJournalofNuclearlMedicineandMolecularImaging
活检/诊刮鉴别恶性肿瘤方面的有效性为:35.5%~86%,特别是在鉴别平滑肌肉瘤方面的有效性为51.5%~64%。总之,它的敏感性和准确性不是很高,但也是必不可少的。

(图17)子宫内膜活检
组织病理学评估包括细胞学非典型程度、有丝分裂指数和凝固性坏死(CTCN),人类肿瘤细胞增殖标记物Ki-67以及可疑CTCN病例中CD34的表达。
有两个或两个因素(19分量表,中有6个或更多分)的病例被归类为LMS;当临界值为6分时,阳性预测值为100%,它可能成为包括术前穿刺活检在内的病例的非常有用的评分系统。
(图18)EuropeanJournalofNuclearlMedicineandMolecularImaging资料
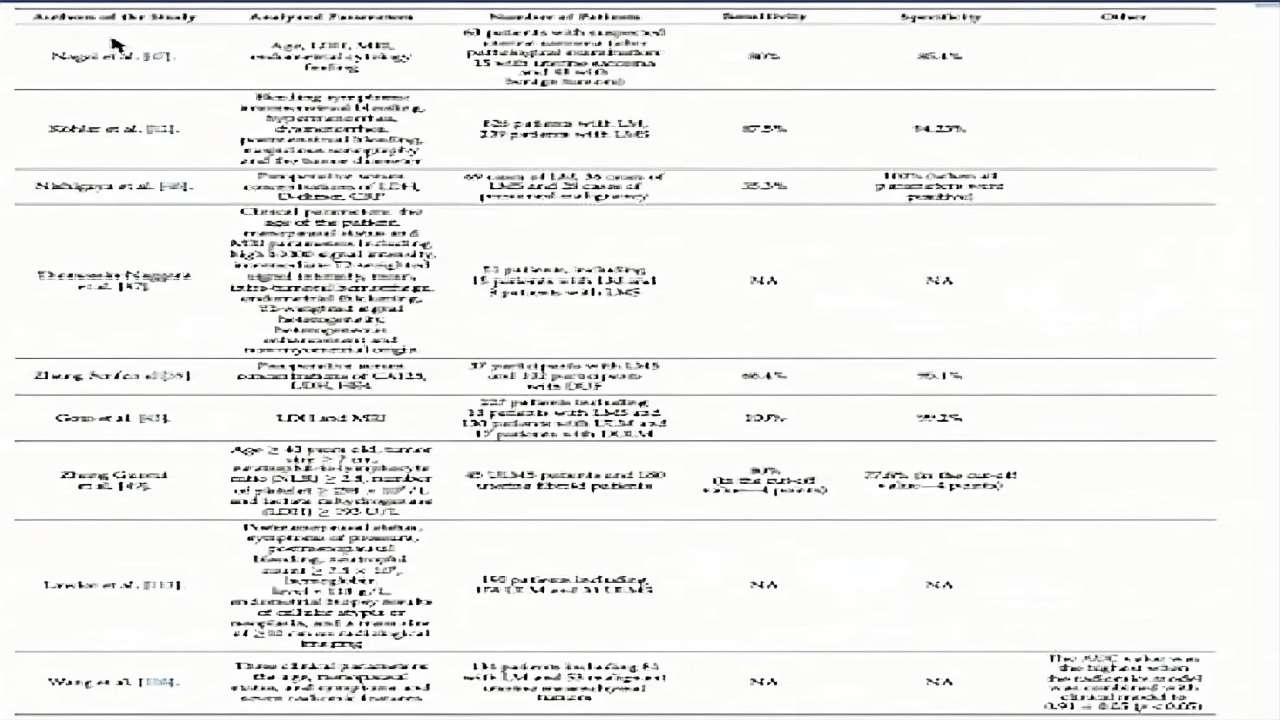
(图19)Cancers(2022)文献资料
综合:临床症状与体征
血清学检查:CA125、LDHMRI/DWI、
PET-CT、病理学、血清miomarks
总之,单项检查对肿瘤的鉴别意义不大,多方面综合的检查更有意义。
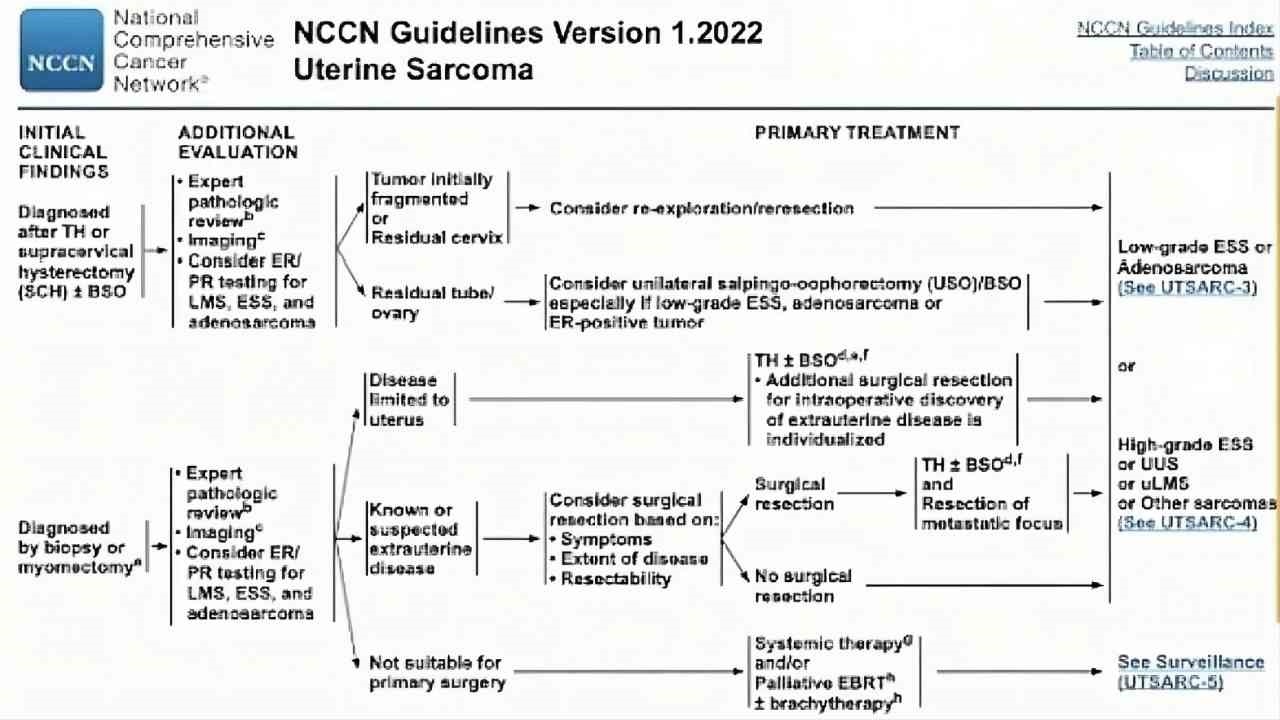
(图20)NCCN指南(2022)子宫肉瘤相关资料
治疗:
标准术式:全子宫+双附件切除
一般不常规系统性盆腔及腹主动脉旁淋巴结切除,术中探查肿大或可疑淋巴结给予切除。
无法手术者:盆腔外照射±近距离放疗和/或全身性治疗。
子宫外有病灶者:切除转移病灶,完整切除子宫肿瘤,禁腹腔内肿瘤分碎术。
术后意外发现的肉瘤处理?
补做手术:再次手术前明确病理,行影像学检查(増强CT/MRI)明确有无盆腔外转移。组织切片ER/PR,有助于决定年轻女性保留卵巢(年轻的ER阴性的早期ULMS可谨慎保留一侧卵巢)。可疑转移淋巴结或肿大淋巴结予以切除,宫外转移病灶切除干净,尽可能彻底减灭肿瘤细胞。
保留生育功能手术?
目前无高级别证据支持子宫肉瘤患者实施保留生育功能手术的安全性。恶性程度高的ULMS、HGESS、UUS等不主张保留子宫手术。早期LGESS、腺肉瘤、横纹肌肉瘤等少数患者,充分知情,排除子宫外转移病灶,术后严密随访,完成生育后切除子宫。
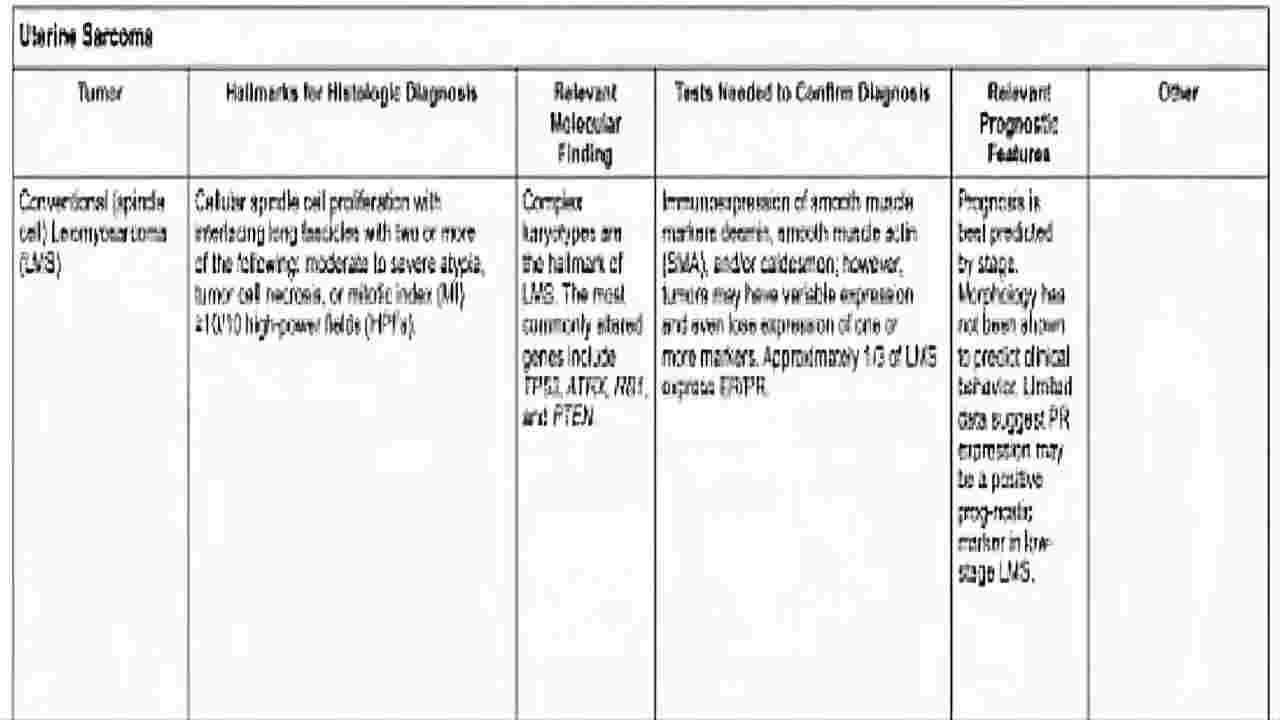
(图21)子宫肉瘤相关辅助诊断及治疗
术后辅助治疗?
根据临床病理预后因素进行修正。
危险因素:子宫切除方式,肿瘤标本是否完整,肿瘤大小,组织学类型,核分裂象,有无脉管浸润。
分子病理学检查:NTRK融合基因、MSI、TMB。
方式:内分泌治疗、辅助化疗、放疗。
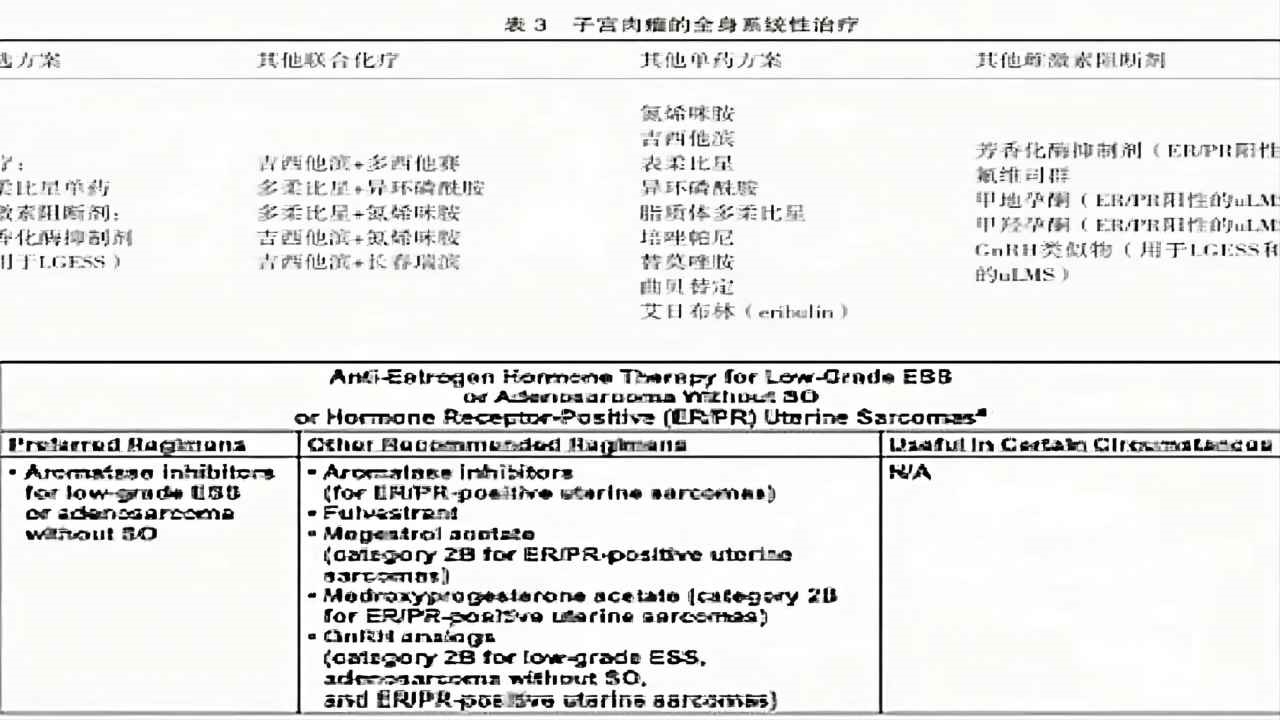
(图22)子宫肉瘤的全身治疗方案
全身系统治疗
雌激素阻断剂:LGESS。
化疗:ULMS、UUS、HGESS,首选单药多柔比星化疗,还有雌激素阻断剂,包括芳香化酶抑制剂,也可联合化疗。
免疫靶向治疗:多在临床研究试验阶段
曲贝替定+多柔比星:ULMS60%ORR;
贝伐珠单抗+多西他赛+吉西他滨:对转移性ULMS无改善;
TMB≥10手术无法切除或全身多处转移的,可选择免疫,帕姆单抗;
NTRK融合基因:拉罗替尼、恩曲替尼。
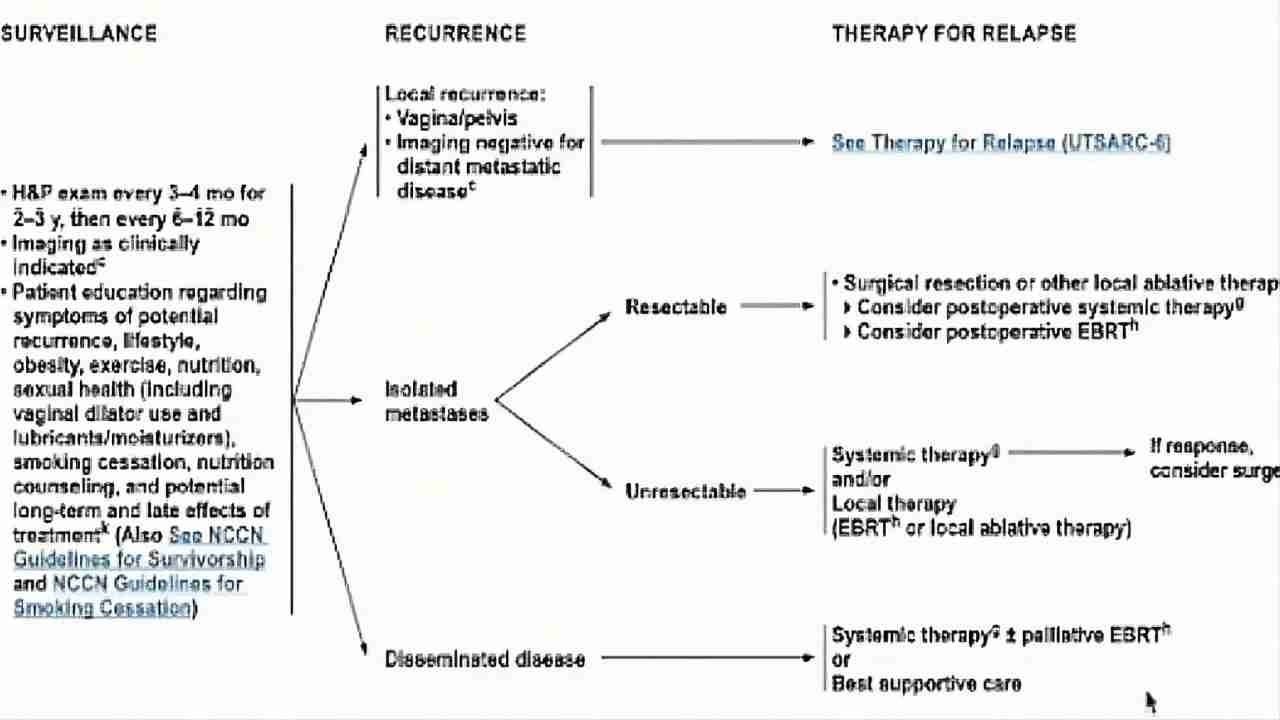
(图23)复发性平滑肌肉瘤治疗方式
治疗:
能否再次手术?以前有无放疗病史?
阴道/盆腔局部复发,无放疗史;
排除远处转移:手术切除±术中放疗+全身性治疗;
术前放疗或全身性治疗+手术治疗+全身性治疗;
无法切干净,术后盆腔外照射±近距离放疗和/或全身性治疗。
有放疗病史:手术切除±术中放疗±全身性治疗;全身性治疗;选择性盆腔外照射和/或近距离放疗。
孤立病灶:手术切干净,术后辅助外放疗和/或全身性治疗;无法切除,全身系统治疗和/或局部治疗(射频消融,立体定向放疗)。

(图24)相关文献关于子宫平滑肌肉瘤回访要点
随访:
全身体检、妇科检查、影像学、健康宣教,前2-3年3个月随访,以后6-12个月随访。

[声明:本网站所有内容,凡未注明来源为“转载”,版权均归巢内网所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:巢内网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们]



















