瘤声机| 浙江大学医学院附属第二医院妇科学术交流会
思考分析及处理
(一)宫颈锥切手术规范及要点
1.概述:
子宫颈锥形切除术是一种宫颈局部切除性手术,是诊断和治疗宫颈癌前期病变及早期浸润癌的重要方法。宫颈锥切术施行中需要切除包括病变在内的宫颈外口、转化区、鳞柱状上皮交界及宫颈管内组织,明确是否存在病变、病变范围、深度、切缘处病变的状况以及是否存在浸润并对浸润癌灶进行镜下测量。
2.手术方式:
①宫颈冷刀锥切术(cold-knifeconization,CKC)。
②子宫颈环形电切术(loopelectrosurgicalexcisionprocedure,LEEP)。
③激光锥切术(laserconization,LC)。
宫颈锥切术是目前治疗宫颈上皮内瘤变Ⅱ~Ⅲ的标准术式,具有诊断和治疗的双重作用。是宫颈癌IA期保留生育手术的方式之一。
但有8%的女性宫颈锥切治疗仍会发生CINⅡ及以上病变。而宫颈锥切术后宫颈病变切缘阳性,是CIN持续或复发的主要危险因素。
宫颈冷刀锥切术
宫颈冷刀锥切术始于18世纪,是传统术式,采用手术刀片锥形切除部分宫颈组织。其优点是切除完整、病理准确,缺点是术中、术后易出血,并发症较多。(如图4)

图4
手术操作规范:
①暴露宫颈,碘伏消毒后以干棉球拭干宫颈表面,Lugol碘溶液标记宫颈病变范围,于宫颈局部注射血管收缩剂和1%利多卡因混合溶液。
②碘不着色区外5mm用手术刀进行锥形切除,刀的角度需朝向宫颈管。
③完成切割后可采用热凝或缝合创面止血。手术中避免用电灼破坏切除标本的边缘组织,以免影响病理诊断。
④有效止血后创面可填塞纱布止血,纱布于24h内取出。
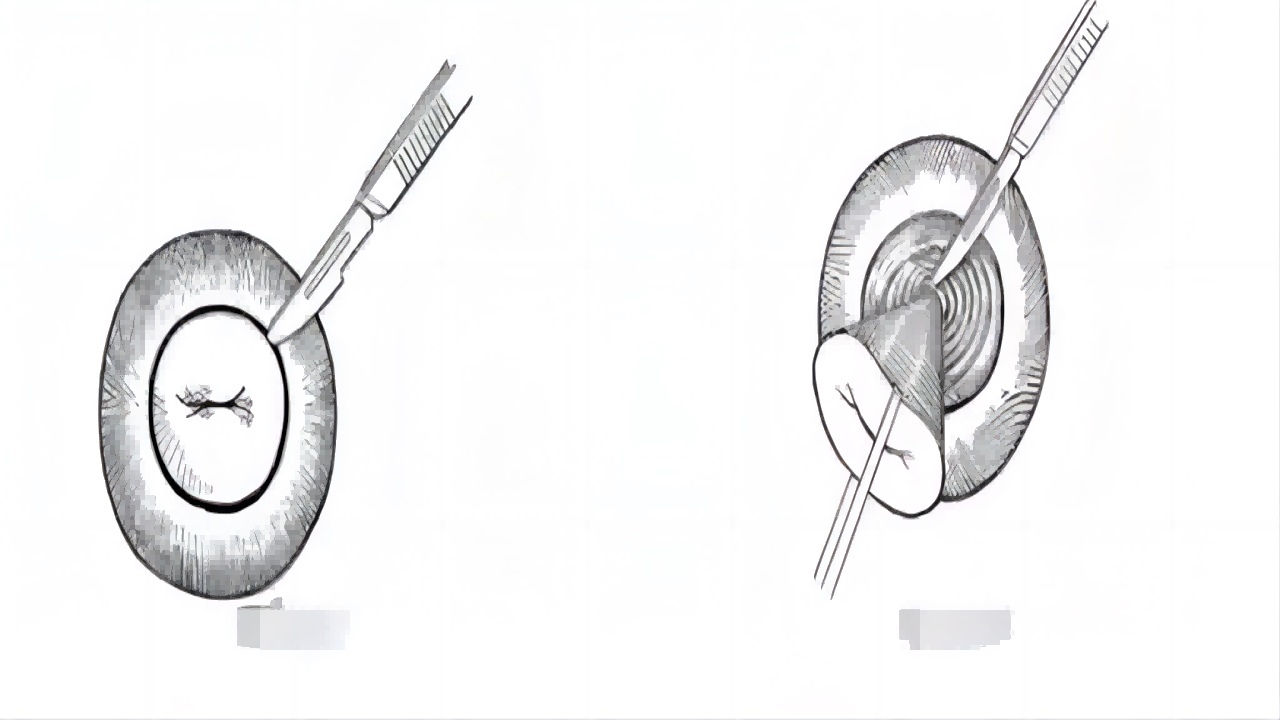
图5:宫颈冷刀锥切示意图
宫颈环形电切术
LEEP:20世纪70年代由法国妇产科医生ReneeCartier发明,替代当时的物理治疗。即Loopelectrosurgicalexcisionalprocedure(LEEP);LargeLoopexcisionofthetransformationzone(LLETZ)。
优点
可在门诊实施、局部麻醉、操作简便、安全、疗效好、并发症少,是目前应用广泛的宫颈锥切方法。
缺点
电热效应对产生的热损伤会影响组织学的诊断(切缘状态或是否存在微小浸润癌);过大或过深的病灶或腺上皮病变的切缘阳性率可能增加,影响疗效。(如图5)
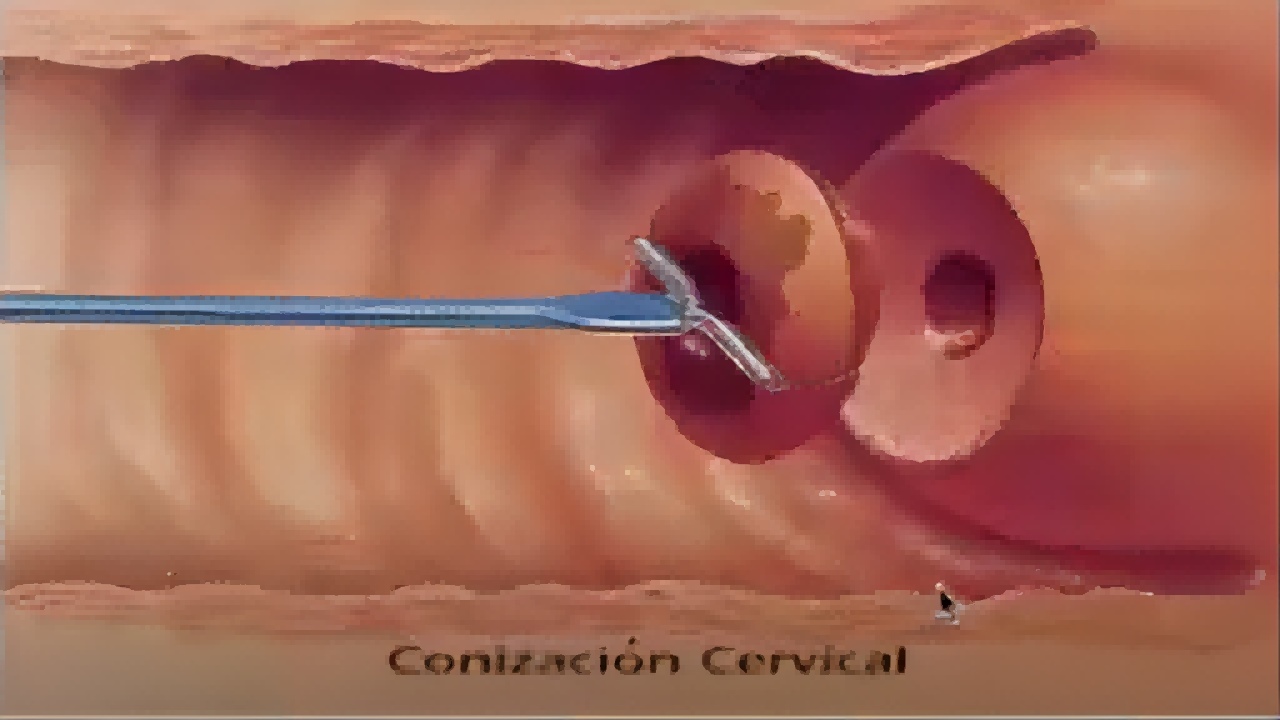
图5
LEEP手术操作规范:
①单步切除法:适用于病变局限者,原则上选择病变最严重部位外侧5mm作为切割的起始点,也可以自下而上从宫颈6点向12点方向,或反之自上而下切除。或从左至右自宫颈3点向9点方向,或反之自右向左切除。采用鱼钩状电极或三角形电极时以宫颈口为支点顺时针或逆时针旋转切除病变。
②多步切除法:适用于病变范围大,不能一次切除者。根据病变情况进行宫颈锥底部、病变外侧缘等不同部位的补切。
3.宫颈锥切术切除范围:
术前结合年龄、子宫颈长度、阴道镜图像、病变分布区域及面积、转化区类型等制定拟切除子宫颈组织的范围,依据国际子宫颈病理与阴道镜联盟(IFCPC)2011年版指南进行规范手术。
转化区类型如下:
①Ⅰ型转化区,行完整的转化区切除(Ⅰ型切除),建议切除深度7~10mm。
②Ⅱ型转化区,在切除转化区的同时切除小部分的子宫颈管组织(Ⅱ型切除),切除深度为10~15mm。
③Ⅲ型转化区,即Ⅲ型切除,因为转化区不能全部显示,无法确定病变组织向子宫颈管内延伸的高度,故切除子宫颈管组织的深度应达15~25mm,以减少子宫颈管切缘阳性率。
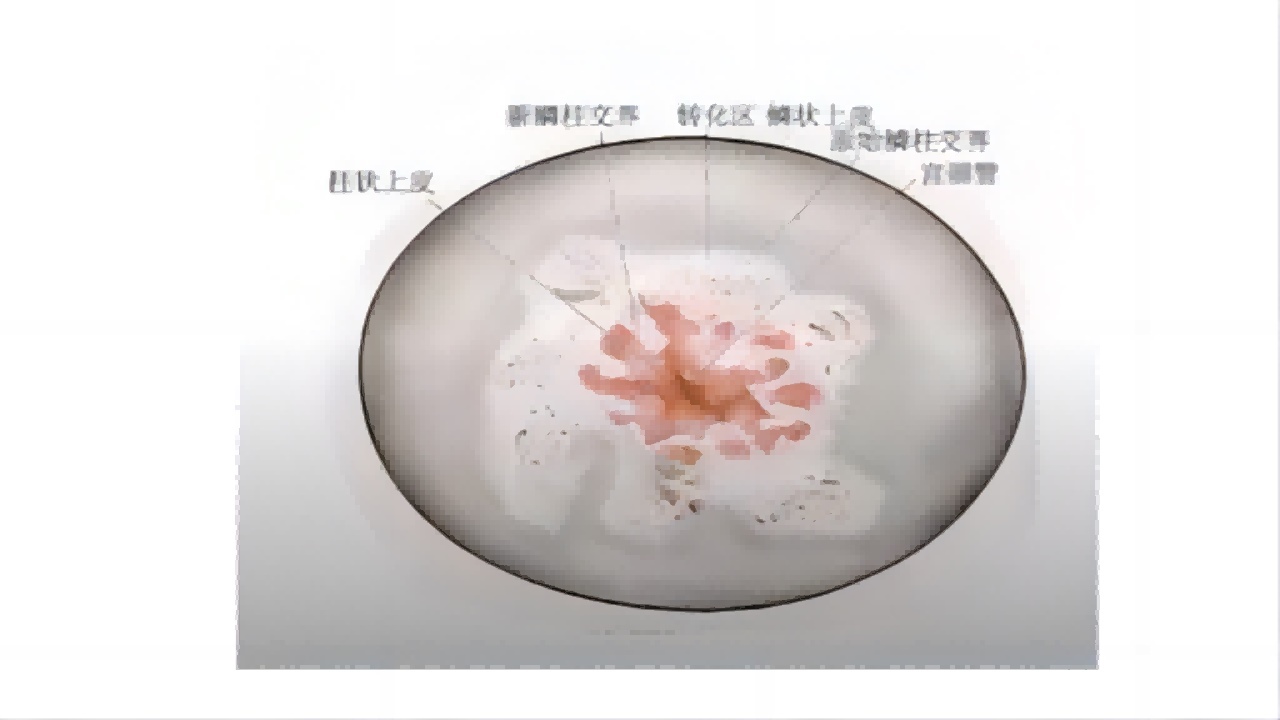
图6:宫颈表皮分布图
4.宫颈锥切手术指征:
①宫颈细胞学为高级别鳞状上皮内病变(HSIL)、不典型腺细胞(AGC)倾向瘤变、原位腺癌(AIS)或癌,阴道镜检查阴性或不满意,或阴道镜指引下的宫颈活检及宫颈管搔刮术(ECC)阴性。
②宫颈细胞学结果与阴道镜指引下的活检组织病理学诊断严重不相符(例如细胞学提示HSIL+,而活检结果为CINⅠ或阴性)。
③活检和(或)ECC病理为HSIL需除外宫颈早期浸润癌或宫颈管内病变。
④活检病理为宫颈原位腺癌,需除外宫颈浸润性腺癌。
⑤阴道镜检查或阴道镜指引下活检病理怀疑早期浸润癌或宫颈原位腺癌。
⑥阴道镜病理提示宫颈HSIL(包括CINⅡ、CINⅢ)、宫颈原位腺癌AIS、鳞状细胞浸润癌的诊断和治疗。
⑦宫颈HSIL(包括CINⅡ、CINⅢ)、宫颈原位腺癌、早期宫颈鳞状细胞浸润癌锥切治疗后病变持续存在、残留或复发。
5.宫颈锥切手术注意事项:
①按照转化区的类型决定宫颈切除的类型。Ⅰ型转化区,切除长度为7~10mm;Ⅱ型转化区,切除的长度为10~15mm;Ⅲ型转化区,切除的长度为15~25mm。
②尽量完整切除宫颈组织,避免碎块切除。
③必须完整规范性记录切除性治疗的类型,测量并记录锥切标本的周径、长度、厚度(从宫颈间质边缘至切除标本的表面)。对于补切的标本同样需要进行测量与记录。
④切除标本可用缝线标记(注明几点),标本应能满足12点连续病理切片的要求。补切标本标明内侧切缘或锥底切缘。
⑤施行再次锥切术的患者,术前再次阴道镜评估,复习既往手术情况,了解宫颈的解剖学变化和宫颈管长度。
⑥妊娠期宫颈锥切术仅用于诊断或排除浸润癌。
(二)切缘阳性的高危因素
锥切切缘阳性定义:
切缘可见到CIN或距离切缘<1.0mm,内切缘或外切缘或内外切缘均累及为阳性。
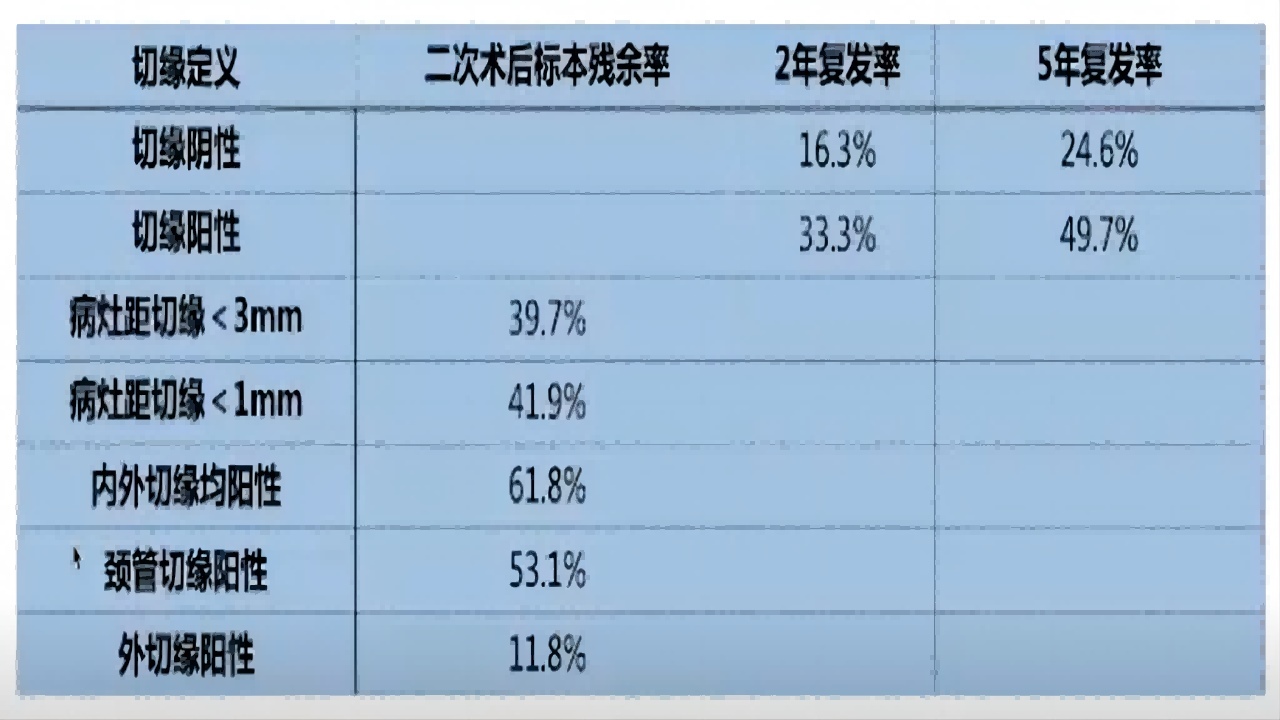
图7
即:
①对锥切切缘阳性定义越严格,术后残余率越高;
②宫颈锥切术后切缘呈阳性与初次手术方式、病变级别、年龄、绝经状态、手术技巧等多种因素相关;
③LEEP、原位癌、病变累及范围是切缘阳性的相关因素;
④边缘受累与锥切类型,手术技巧和组织学诊断有显著相关性;
⑤经验丰富的阴道镜专家切缘阳性率发生较低。
文献回顾
1.高危因素-锥切方式
Xing-shengYan等报道:
CKC组和LEEP组切缘阳性率分别为5.89%和12.09%,手术方式CKC组和LEEP组差异有统计学意义(P<.001)。(如图8)
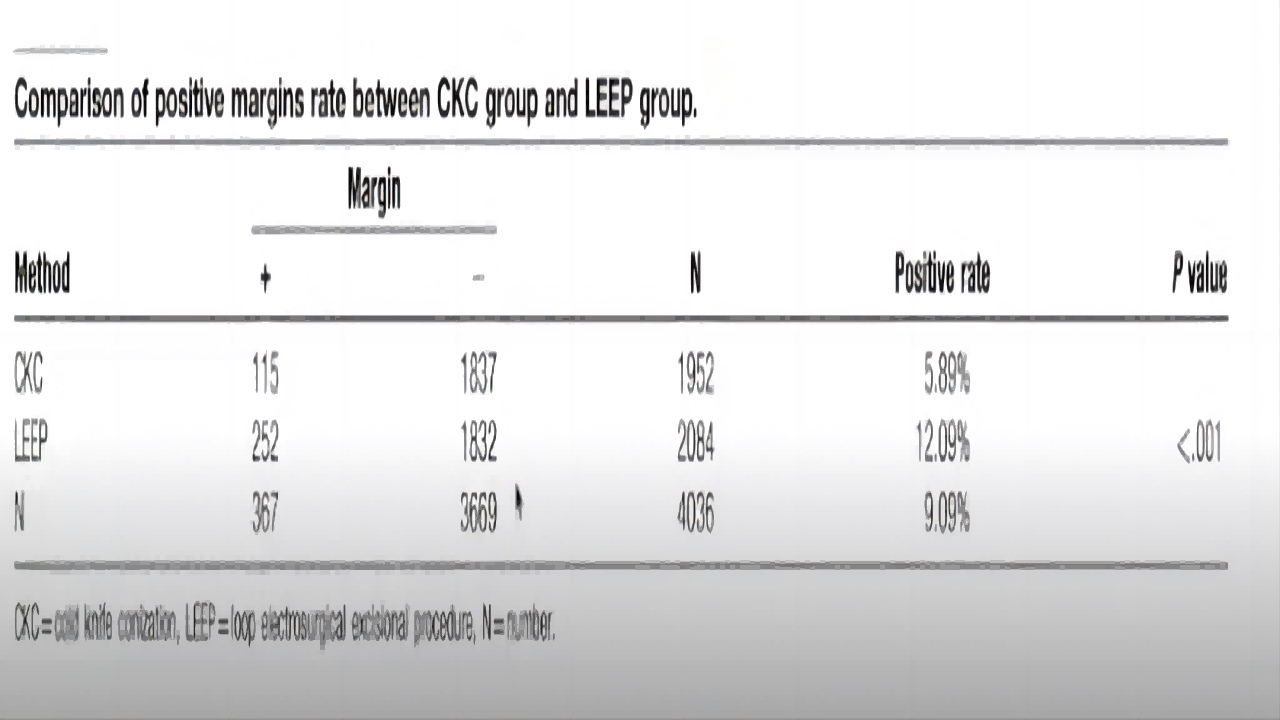
图8
2.残留病灶与临床病理因素
①妊娠期(P=476)、胎次(P=.177)、TCT(P=701)和腺受累(P=1)对残留病变的预测价值较低。
②年龄(P=0.027)、绝经状态(P=.006)和HPV感染(P=.018)是残留病变的重要因素。(如图9)
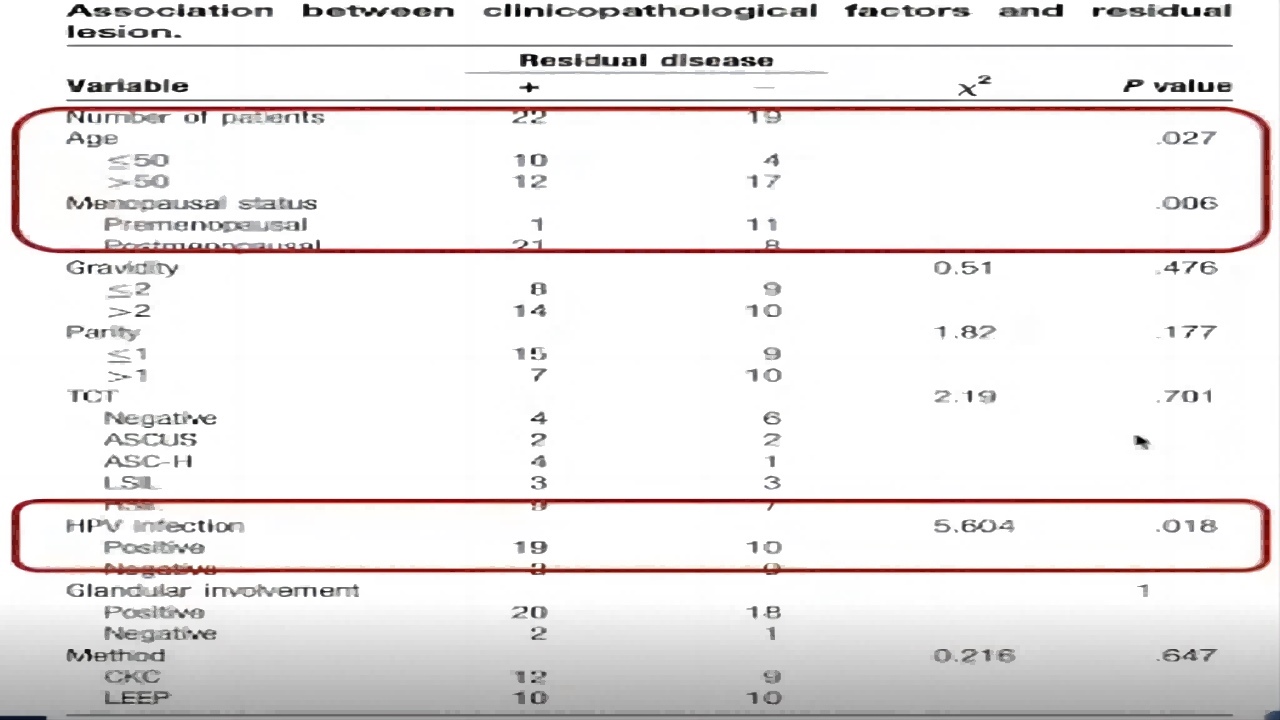
图9
3.切缘阳性与复发率
①CKC组VSLEEP切缘阳性复发无差异。
②50岁以上切缘阳性的女性CIN复发无显著差异。
③HPV阳性是切缘阳性复发的高危因素。
④是否累腺对复发产生影响。
⑤术前TCT的结果,若TCT结果显示HSIL时,病变复发的频率较高。(如图10)
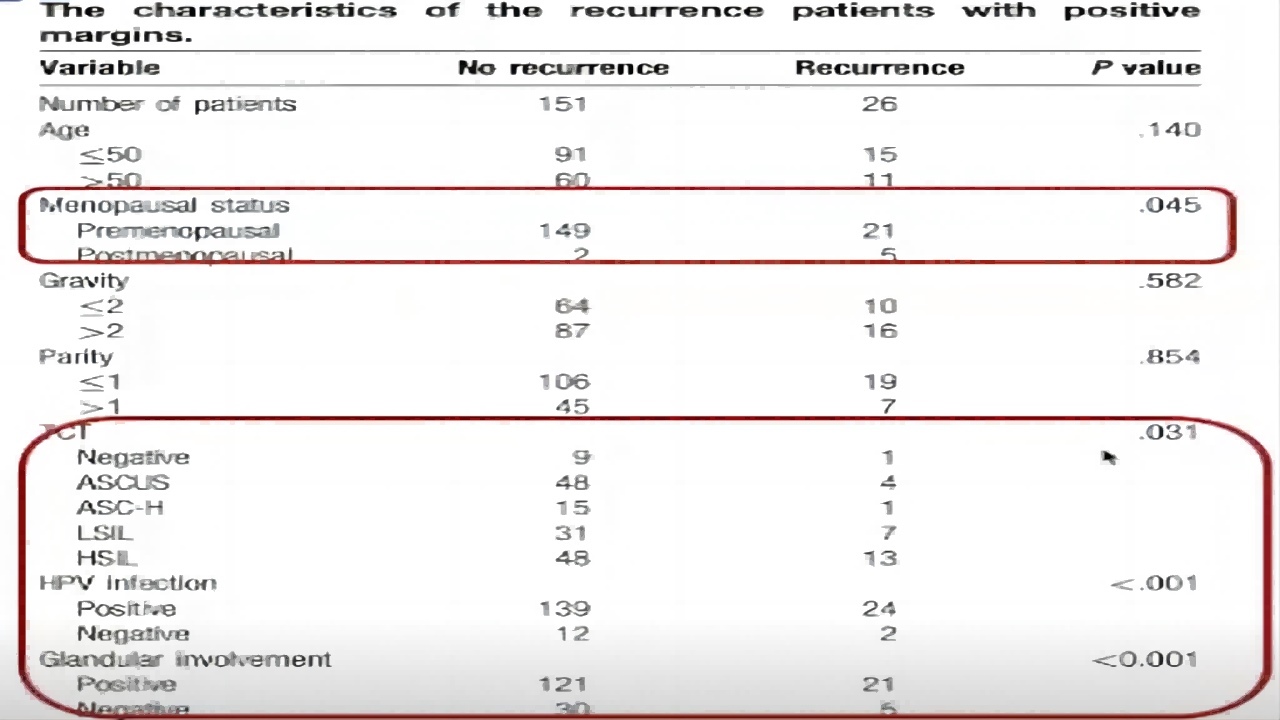
图10
4.复发高危因素
切缘情况与锥切术后病变残留或复发的关系
①19个研究,OR=3.64,95%CI:3.0-4.43,P<0.00001。
②切缘阳性是CIN锥切术后病变残留或复发的危险因素。(如图11)
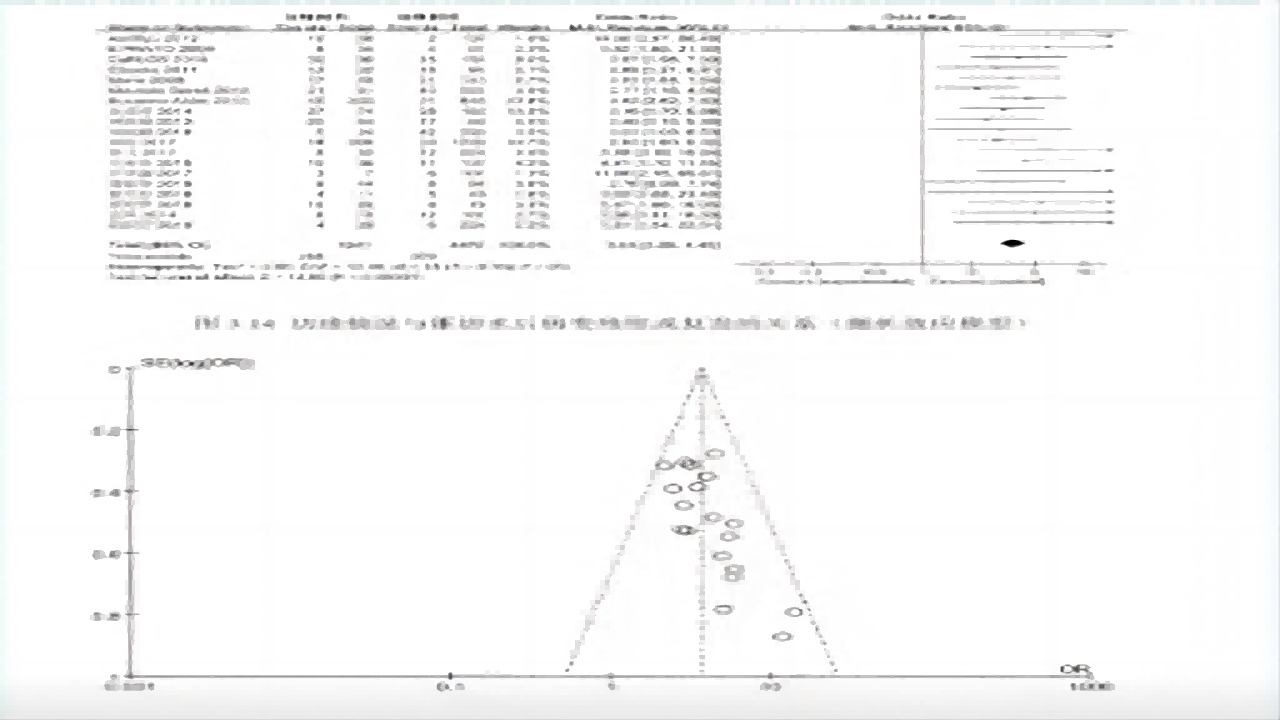
图11
绝经与锥切术后病变残留或复发的关系
①9个研究,OR=3.18,95%CI:2.26-4.49,P<0.00001。
②绝经是CIN锥切术后病变残留或复发的危险因素。(如图12)

图12
腺体累及与锥切术后病变残留或复发的关系
①17个研究,OR=2.81,95%CI:1.77-4.45,P<0.0001。
②累腺是CIN锥切术后病变残留或复发的危险因素。(如图13)
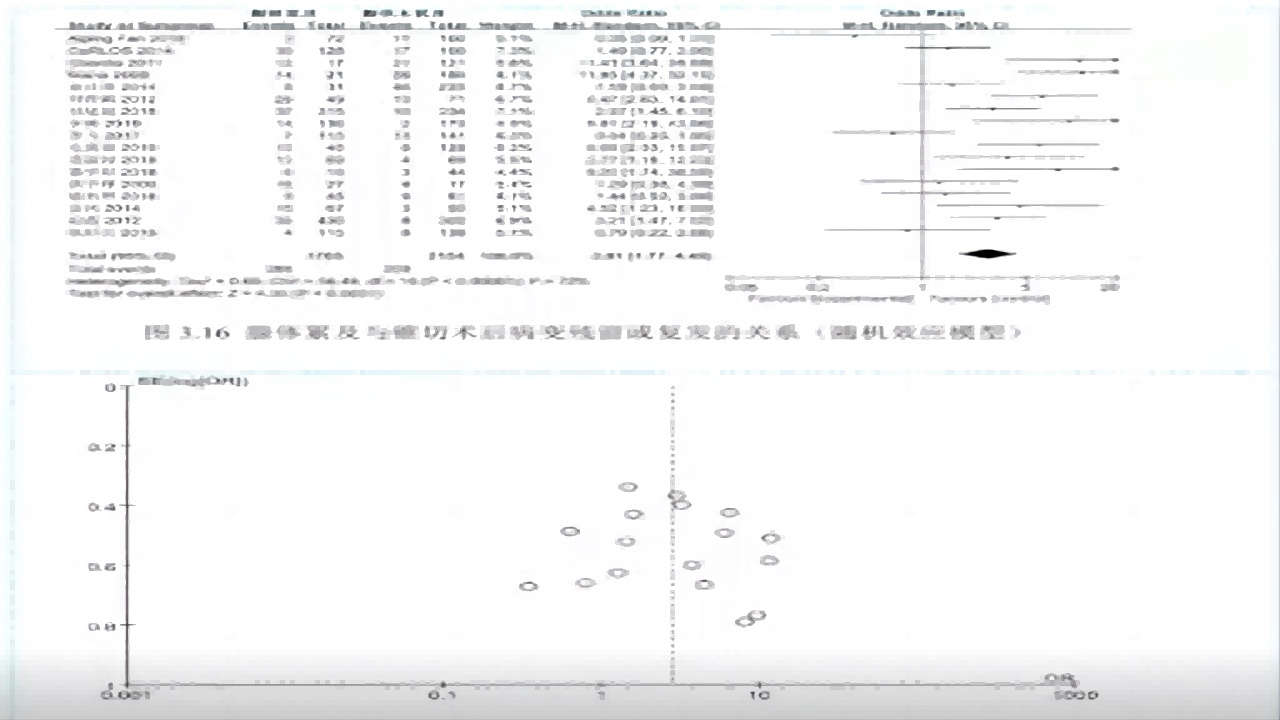
图13
病变级别与锥切术后病变残留或复发的关系
①5个研究,差异无统计学意义。
②病变级别与CIN锥切术后病变残留或复发无明显相关性。(如图14)
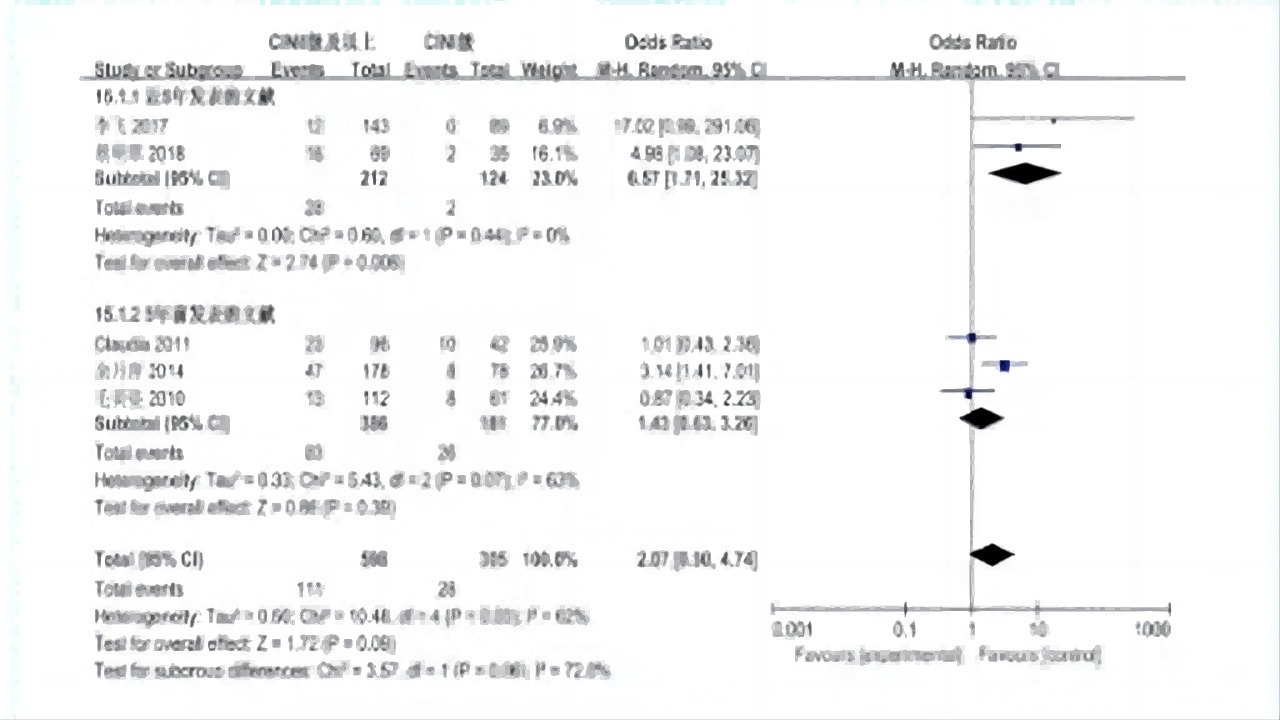
图14
宫颈锥切术的范围包括移行带周围和其下的部分锥形组织。切除的宽度大致为移行带外3-5mm,切除深度约15-25mm,具体的由病灶部位决定:若病变处于宫颈表面,锥形切除呈宽而浅;若病变累及颈管,则锥切宜为狭而深的锥形。
锥切宽度≤1.5cm易引起病变残留或复发(OR=2.25,95%CI:1.12-4.55,P=0023),而与锥切高度无关,宫颈锥切体积>1.93cm³,发生病灶残留的可能性小。
当锥切宽度<1.77cm时,预测患者术后复发或病变持续的敏感度为88.9%,特异度为83.8%。
Meta分析结果:锥切宽度<2cm是病变残留或复发的危险因素(OR=4.51,95%CI:1.81-11.21,P=0.001)。
锥切宽度与锥切术后病变残留或复发的关系
①2个研究,这些研究将所有病例分为锥切宽度≥2cm和<2cm,差异具有统计学意义。
②锥切范围不足是CIN锥切术后病变残留或复发的危险因素。(如图15)
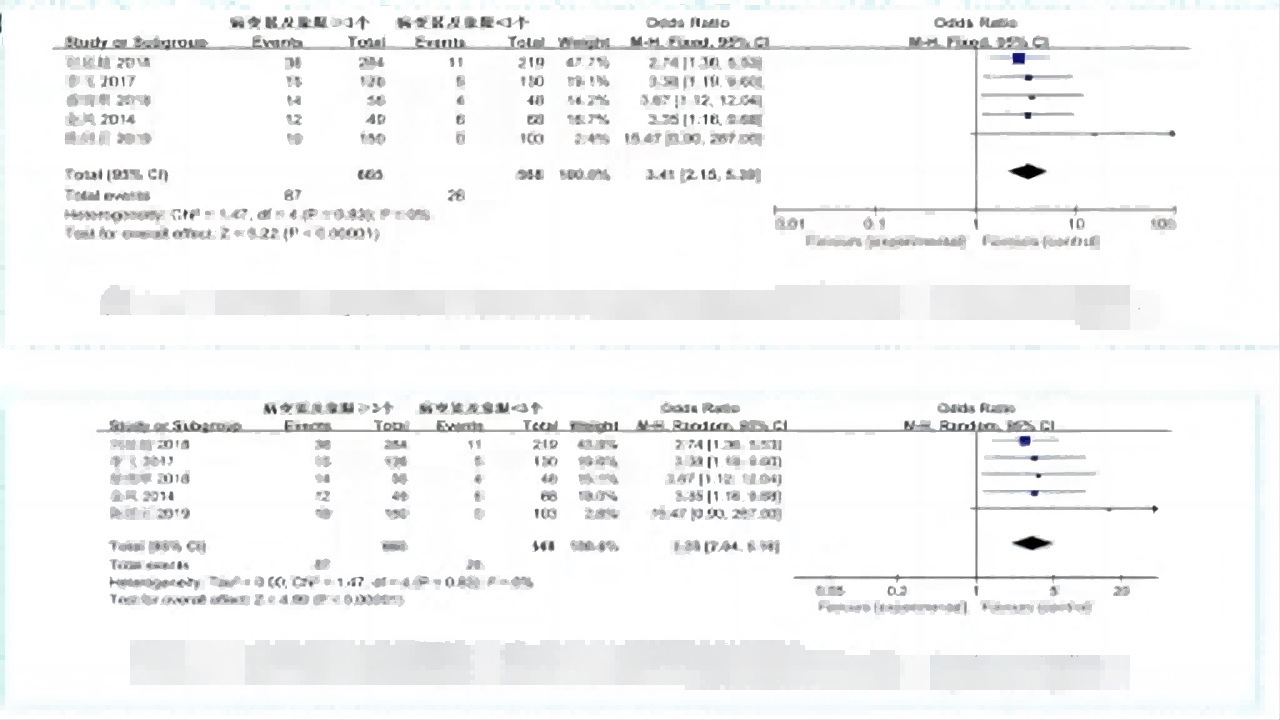
图15
术前HPV负荷量与锥切术后病变残留或复发的关系
①共纳入4个研究,所有病例分为HPV负荷量≥500RLU/PC和<500RLU/PC,得出合并效应量OR=7.49,95%CI:4.05-13.85,P<0.00001),差异具有统计学意义。
②术前HPV负荷量≥500RLU/PC是CIN锥切术后病变残留或复发的危险因素。
术后HPV持续感染与锥切术后病变残留或复发的关系
①7个研究,OR=11.38,95%CI:6.84-18.94P<000001)。
②术后HPV持续感染是CIN锥切术后病变残留或复发的危险因素。(如图16)
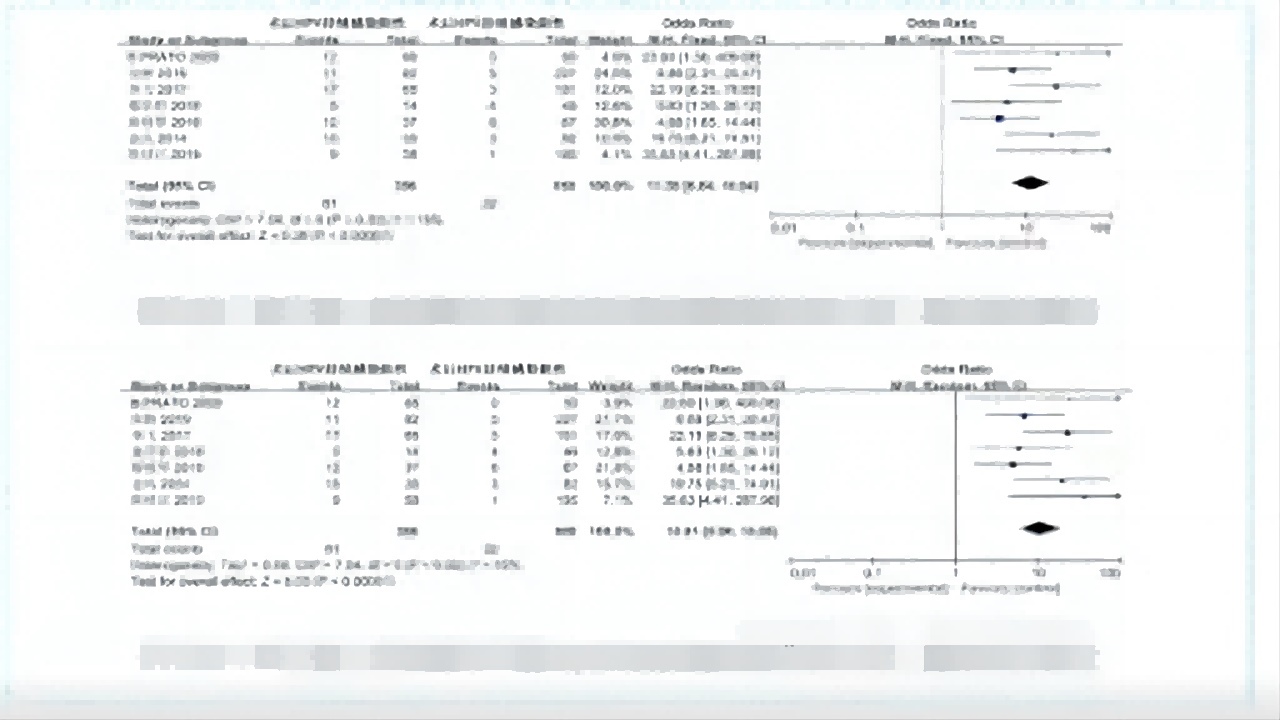
图16
锥切术后HPV持续感染率
治疗后是否复发与多种高危因素有关,包括年龄、治疗前细胞学异常程度、HPV型别、病变程度范围、既往治疗史、转化区类型、切除锥体大小、医生技巧及患者的免疫状态等治疗后的HPV阳性率较高,约25%。其中治疗后3~11个月,高危型HPV检出率达24%,治疗后12~24个月达21%。(如图17)
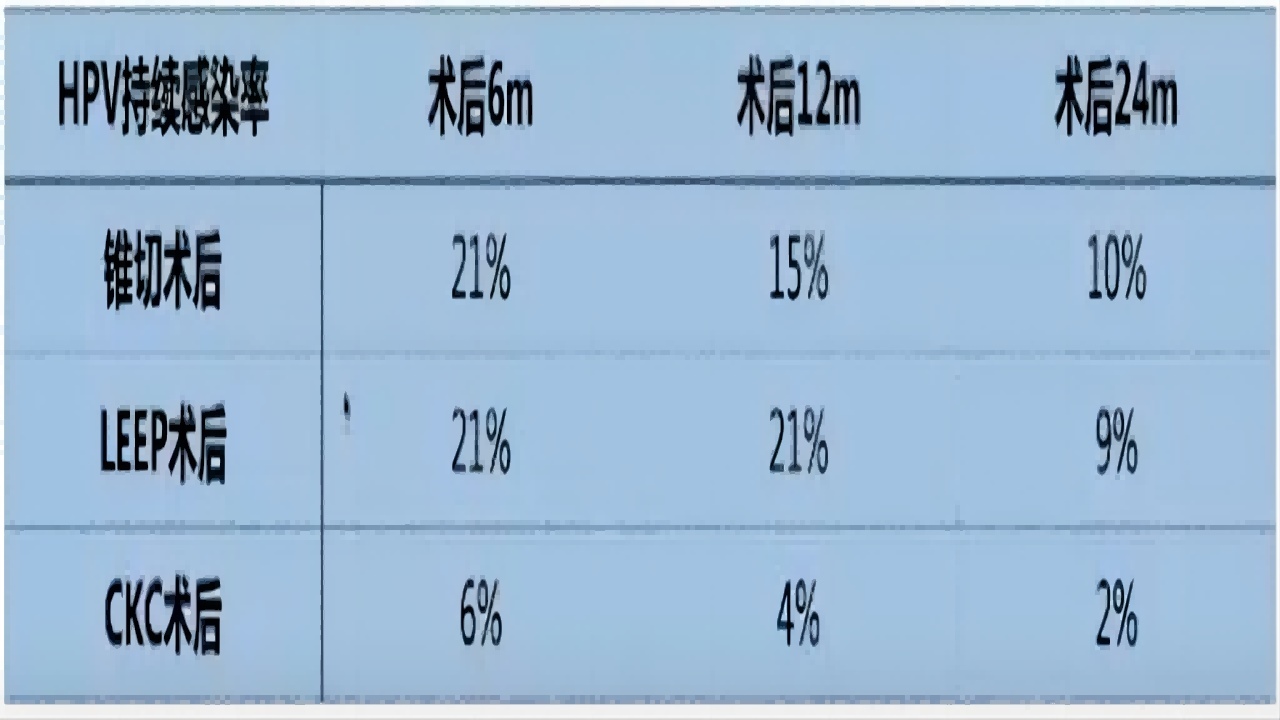
图17
(三)锥切切缘阳性的处理策略
知情告知:锥切术后无论切缘状况如何,病变持续存在或复发风险均一直存在,应向患者告知进一步观察与治疗的相对危险性。
对初次锥切术后宫颈病变标本切缘呈阳性患者,可选择的治疗方式包括:密切随访,再次进行宫颈病变诊断性切除术,或进行全子宫切除术。
Berek&Novak指出:
1.切缘阳性优先每4-6月宫颈筛查。
2.重复性的诊断性切除可接受。
3.组织学证实CIN2/3复发残留,允许重复性切除或子宫切除。
1.随访:
①hrHPV检测:宫颈锥切术后6月HPV结果阳性,术后存在病变残留或宫颈病变的可能性大,临床须密切监测;
②宫颈细胞学检测:既往为内切缘呈阳性及高级别CIN病变者,应注重宫颈内刮除。
《妇科肿瘤学》提示:
1.切缘为CINI级,可观察不予处理。
2.切缘为CINI/Ⅲ或ECC阳性,推荐保守处理,随诊4-6月复查HPV、细胞学
及ECC,或再次宫颈切除术。
3.无法重复锥切或CIS累腺,多灶或累及颈管,无生育要求,可子宫切除。
2.术后hr-HPV持续阳性处理:
①锥切术后随访hrHPV阳性患者,明确是否有病变及病变部位性质,不推荐直接重复锥切术或子宫切除。
②组织学诊断复发或持续性HSIL,选择再次子宫颈锥切术,若再次锥切难以实施,考虑全子宫切除。
③组织学诊断LSIL或更轻程度而细胞学为HSIL或ASC-H,推荐首先复核细胞学、组织学及阴道镜结果,若得出修正结果按新的结果进行规范化处理;若结果不变细胞学HSIL者建议行诊断性锥切术,排除隐匿性HSIL,对于阴道镜下完整鳞柱交界和病变上界均可见且ECC<CINⅡ者,可选择密切随访,6~12个月复查基于HPV的检测和阴道镜。
④细胞学ASC-H若阴道镜下完整鳞柱交界和上界均可见ECC阴性,建议密切随访而不建议行诊断性锥切术。当组织学诊断为LSIL或更轻程度而细胞学为NILM、ASCUS、LSIL,推荐继续随访,12个月复查基于HPV的检测,随访期间应鼓励患者通过改善生活方式、调整心理健康等方法提高机体免疫力。
3.再次宫颈锥切术:
①患者接受初次宫颈锥切术后,宫颈病变标本切缘呈阳性或术后复发的患者。
②患者年龄较小,有保留子宫的意愿和或有生育要求,而且患者对CIN有一
定认识,愿意接受定期随访。
③随访过程中宫颈细胞学、阴道镜和组织学检查结果异常者。
注意事项:
①短期内进行第二次宫颈手术,感染的危险性增高。
②再次宫颈锥切术切除宫颈组织过多,导致宫颈功能不全时,可造成不良妊娠结局。
③再次宫颈锥切术可致宫颈黏连,经血不畅及闭经。
④宫颈组织少,使再次手术难度增加,导致术中及术后出血风险增大;
⑥再次进行宫颈锥切术后,仍然存在宫颈病变标本切缘呈阳性、病变残留或复发的风险;
⑦切缘为CINⅠ-Ⅱ可考虑严密随访,切缘CINⅢ有生育要求者可不补充手术。
4.全子宫切除术:
对宫颈锥切术后宫颈病变标本切缘呈阳性患者进行子宫全切术的适应症:
①绝经后妇女。
②年龄较大,无生育要求,希望切除子宫者。
③残留宫颈组织过少,CKC困难者。
HSIL行全子宫切除是阴道上皮内病变或阴道其他病变的高危风险。
5.绝经后CIN的锥切与子宫切除:
①绝经后妇女宫颈锥切易引起膀胱直肠损伤,子宫颈管粘连及病变残留。
②全子宫切除术也可应用于该人群的初始治疗,但术前应最大程度的排除浸润癌。
③术中可行冰冻切片病理检查,避免锥切术后高切缘阳性率及高复发率的问题,降低多次手术给患者带来的创伤。
④对于绝经后HSIL患者,全面平衡临床病理及患者年龄、病变大小、病变累及腺体及宫颈鳞柱交界等,尽量先行宫颈锥切术,评估有无间质浸润,根据术后病理再选择下一步处理。
⑤筛查机会少,随访条件缺乏,行锥切手术困难的患者,需在全面评估排除浸润癌的基础上行筋膜外全子宫切除术。
6.AIS锥切切缘阳性:
宫颈冷刀锥切为AIS保守治疗首选术式,有生育要求患者,应尽可能完整地切除病灶,尽可能地保留宫颈以减少妊娠并发症。
ASCCP指南提出(如图18):
AIS患者可选择CKC或LEEP,但应保证标本的完整性及切缘病理情况可判断;手术应按Ⅲ型转化区类型切除,设计成窄长锥形并延伸至宫颈内口,切除深度应达15~25mm;对于年轻、转化区Ⅰ型或Ⅱ型的AIS,切除深度可在鳞柱交界上至少1cm,减少手术对妊娠的影响。
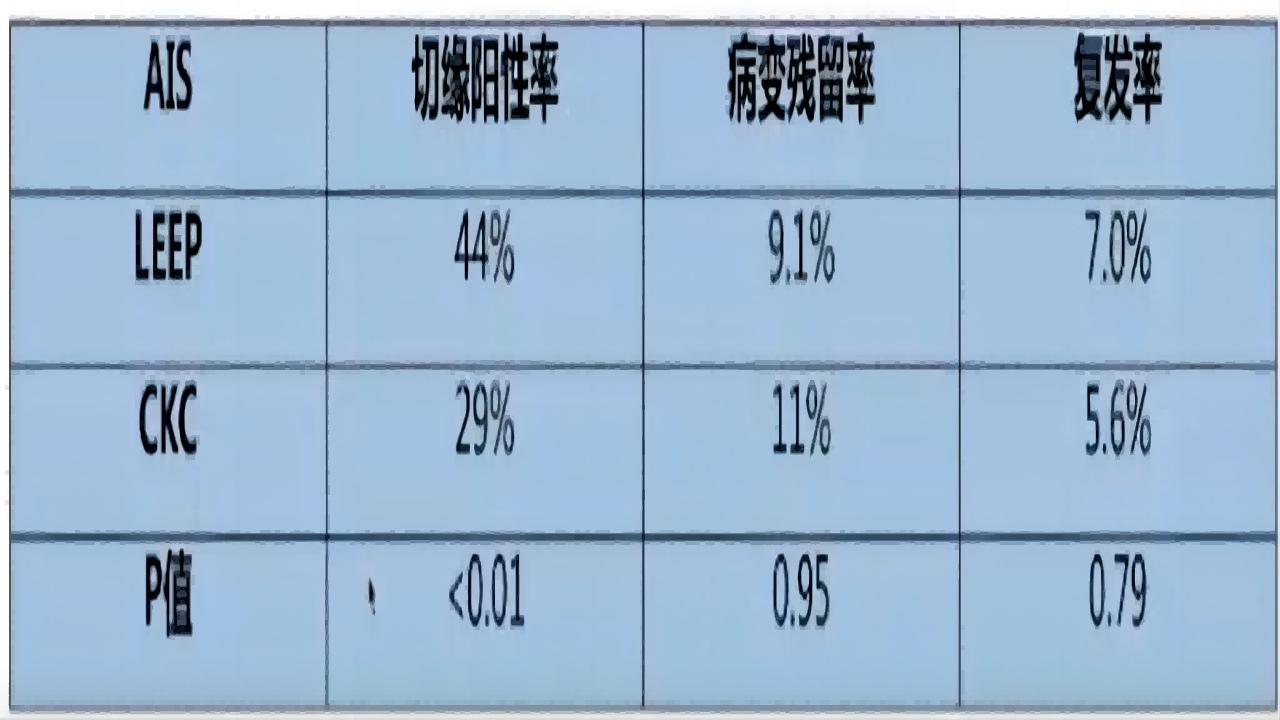
图18
ASCCP2019指南(如图19):
活检确诊的AIS患者,建议诊断性切除手术,除外浸润性腺癌,即使最终计划进行子宫切除术也应如此。
当AIS锥切切缘阴性,可进行单纯子宫切除,当切缘阳性时,需要二次切除以保证切缘阴性,即使计划切除全子宫。如果无法保证阴性切缘,保留生育的处理也是不推荐的。
达到理想的标本长度,在实施LEEP后进行”牛仔帽”式颈管切除使标本破坏是不可取的,切除标本深度至少10mm对于无未来生育要求者,可将切除标本深度增加至18~20mm。
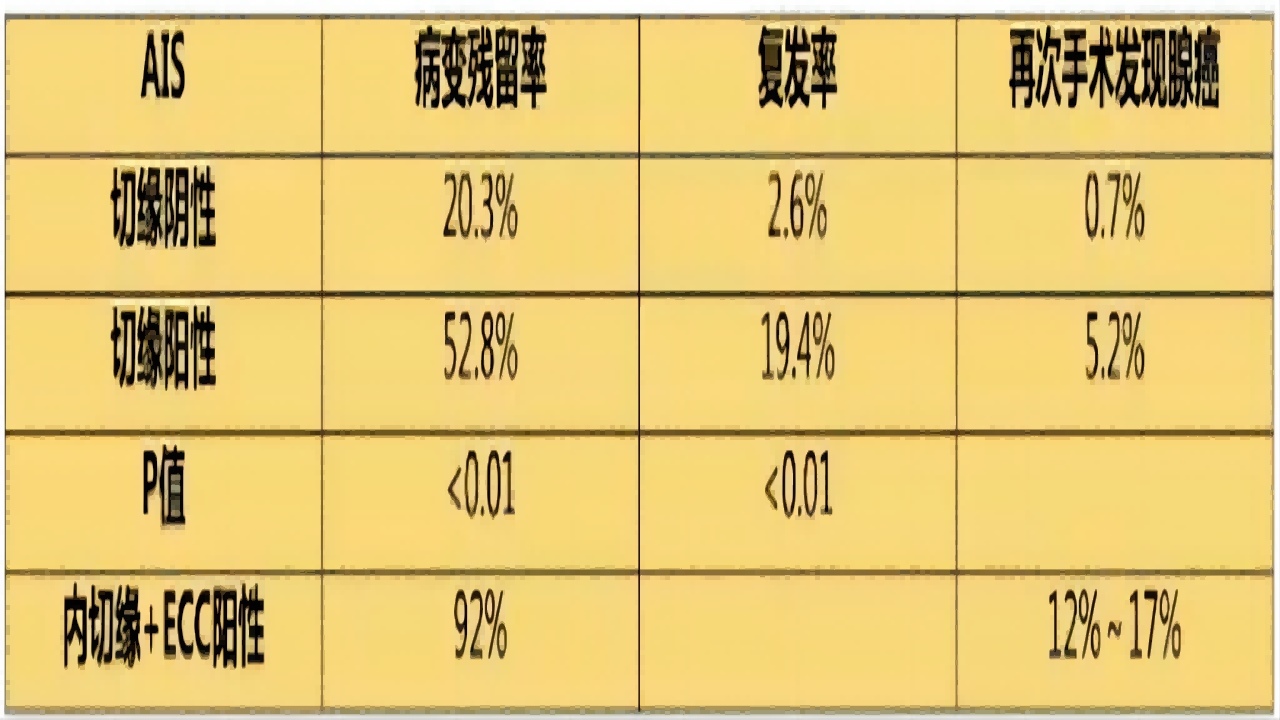
图19

[声明:本网站所有内容,凡未注明来源为“转载”,版权均归巢内网所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:巢内网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们]



















