
导读:不同亚型的载脂蛋白E(APOE)决定了迟发性阿尔茨海默病(AD)的患病风险,但其联系的机制知之甚少。尤其是APOE和淀粉样蛋白-β(Aβ)之间直接相互作用的相关性仍然存在争议。近期,《NatureCommunications》在线发表了题为“Co-aggregationwithApolipoproteinEmodulatesthefunctionofAmyloid-βinAlzheimer’sdisease”的研究论文,作者揭示了APOE和Aβ如何通过动态相互作用在整个聚集过程中调控Aβ聚集体。该研究结果通过证明APOE如何以亚型和脂质化特异性方式调节Aβ的聚集、清除和毒性,将遗传的APOE基因型与患AD的风险联系起来,并发现选择性去除非脂质化的APOE4-Aβ共聚集体可增强神经胶质细胞对有毒Aβ的清除,并减少炎症标志物的分泌和膜损伤,为AD治疗提供了新的思路。

结果1.早期APOE-Aβ共聚集体在AD大脑中独立形成亚型,但依赖于亚型积累
聚集aβ包括一个动态的、不同大小、形状和属性的异质物种混合物,小的亚种群可能不同程度地影响AD进程。作者推断APOE可能通过与Aβ聚集体相互作用来影响AD,这可能解释了为什么以前通过拍摄大量混合物的图片来研究关联的尝试所描绘的画面不一致。在存在和不存在接近生理浓度的每种非脂化和脂化APOE亚型(~80nM)的情况下,Aβ42浓度在4µM下会产生原纤维。
使用ThT荧光检测纤维形成证实,所有反应都产生纤维,非脂化APOE的存在减缓了聚集,而脂化APOE的存在加速了反应(图1A,图S1,S2);脂质颗粒通过提供初级成核的表面而加速淀粉样蛋白的聚集。为了分析每个聚集途径的异质性,作者在反应的不同阶段对单个聚集进行了表征,在滞后期(t1)、生长期中期(t2)和平台期(t3)对每个聚集反应进行了成像,使用单分子下拉(SiMPull)(图1B)。在该实验中(图1C),Aβ42使用表面固定的6E10抗体捕获,并在添加Aβ(alexa-fluor-647标记的6E10)和APOE(alexa-fluor-488标记的EPR19392)的初级检测抗体后使用双色全内反射荧光(TIRF)成像(图S4)。使用相同的单克隆抗体夹夹Aβ聚集体使未反应的单体无法检测。
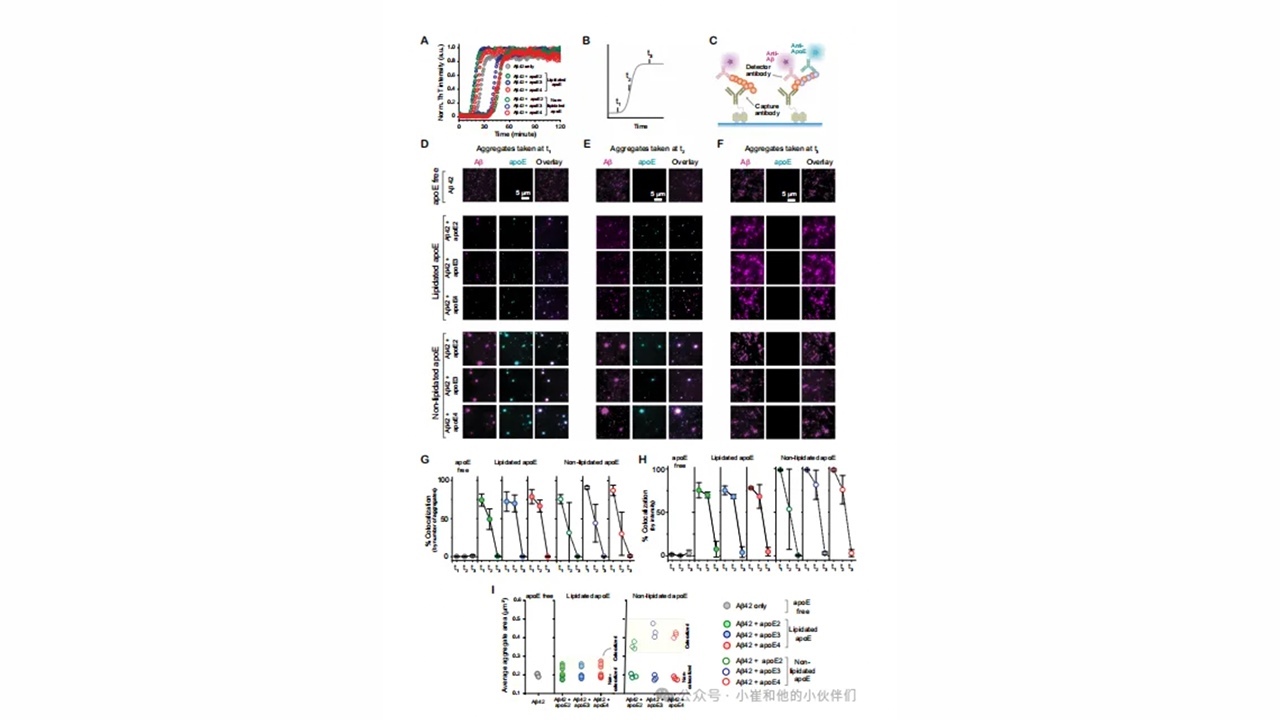
图1.APOE和Aβ在形成纤维的过程中短暂共聚集。
表征单个聚集体,而不是它们的总体平均值,进而得到异质种群的特性,包括大小、形状和组成;含有APOE和Aβ42的聚集体应该在两个检测通道中都有定位。由图片分析得知(图1D-F),所有类型的APOE在聚集的早期阶段(t1和t2)与Aβ42共聚集,但随着反应完成,这种共聚集消失。用Aβ抗体包被的珠粒对t1和t3聚集体进行共免疫沉淀,然后对Aβ和APOE进行westernblotting,证实APOE不存在于t3共聚集体中(图2)。无论是基于聚集体数量(图1G)还是强度(图1H),共定位的程度都没有显著的亚型依赖性。这些发现与用于检测APOE的抗体无关(图S5),当使用同型控制检测抗体时,没有共定位(图S6和S7),表明非特异性结合的贡献很小。使用强度作为每个聚集体中存在的蛋白质量的代表表明,滞后期约5-100%的聚集体是共聚集体,在生长期下降到约30%-60%,在平台期下降到约0%(图1H)。尽管非脂化APOE与Aβ42共定位的水平略高,但脂化的主要影响是共聚集体的表观大小(图1I),含有非脂化APOE的共聚集体(平均直径约为500-900nm)比含有脂化APOE的共聚集体(平均直径~200-250nm或更小;在衍射极限成像中,任何小于衍射极限的聚集体都会出现在这个范围内)或不含APOE大。
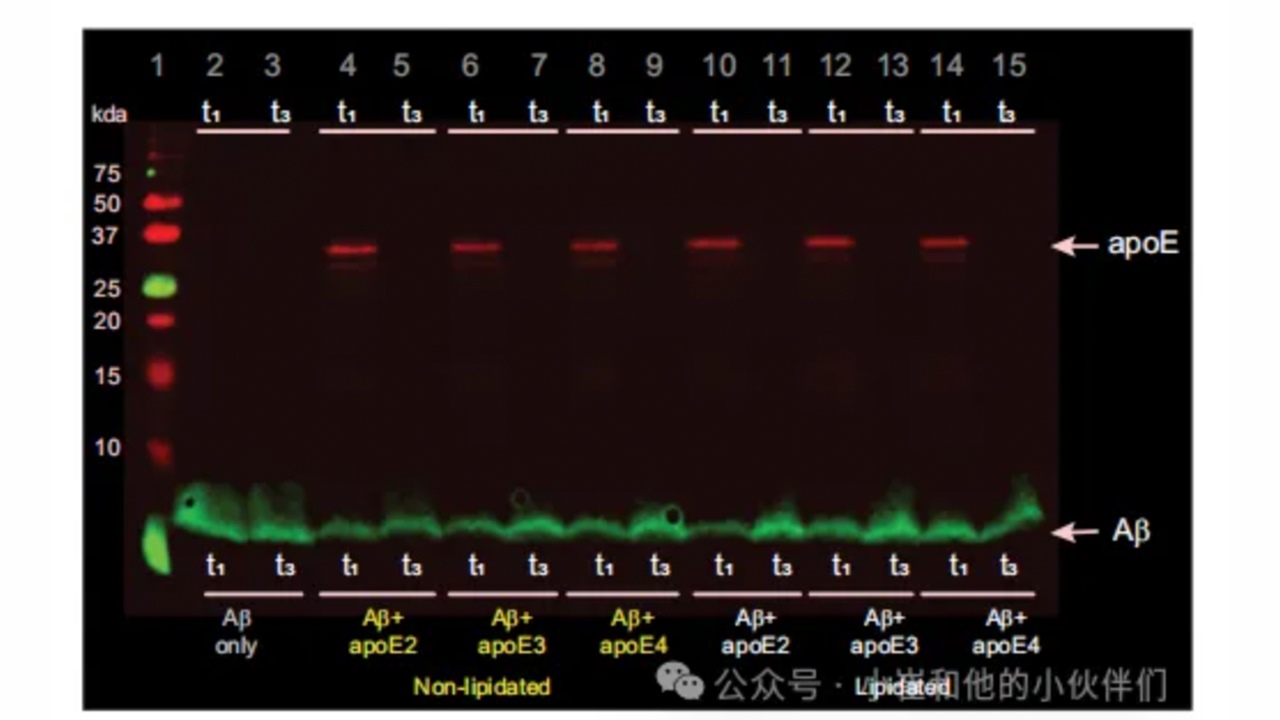
图2.APOE与Aβ在早期聚集物而非原纤维中相互作用。
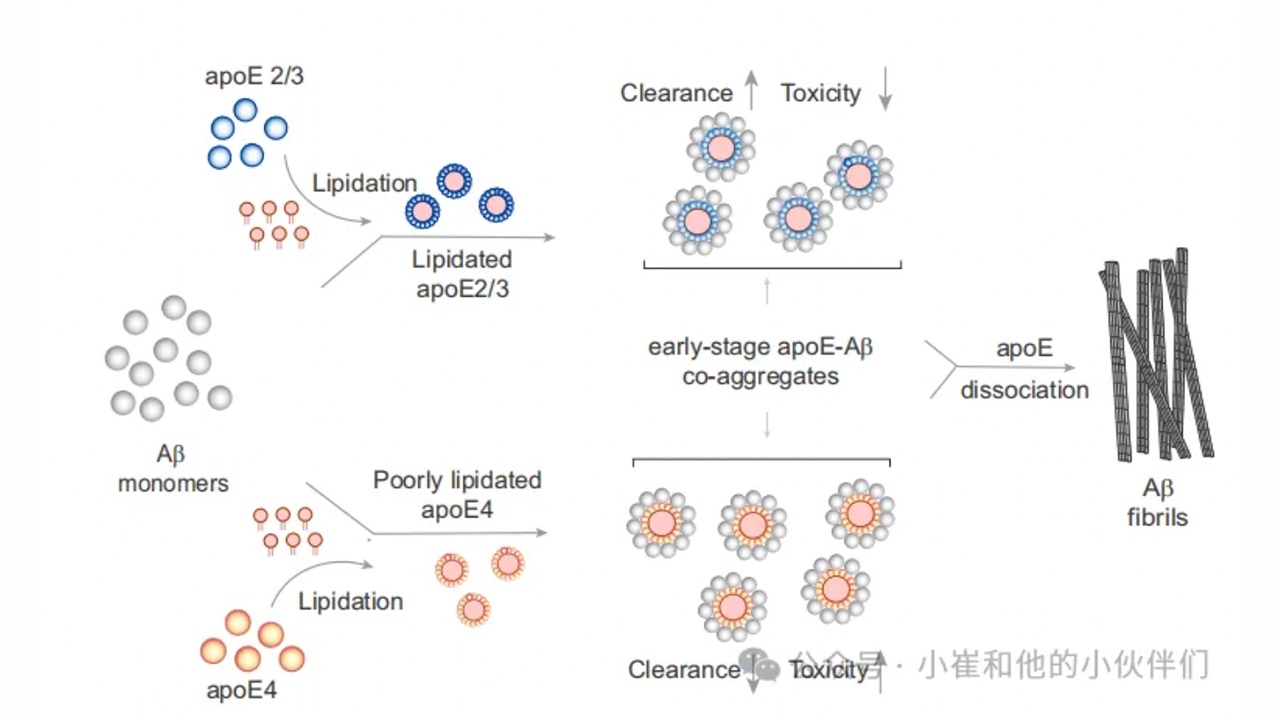
作者发现非脂化APOE在早期与Aβ形成大的共聚集体,这支持了这种形式的APOE可以稳定聚集早期形成的中间物,从而抑制Aβ纤维化的观点。因为作者使用了亚化学计量的APOE(Aβ:APOE=50:1),所以隔离Aβ单体不太可能减慢聚集。APOE更可能在Aβ42聚集的早期阶段与之相互作用,APOE与预先形成的Aβ42聚集体没有关联(图S8)。这些早期共聚集体的高荧光强度表明高有效蛋白质浓度与降低的成纤率不符。然而,最近的研究表明,在凝析油中局部富集Aβ42可以显著减缓其聚集。原纤维使APOE脱落这一事实可能表明,伸长的异核在能量上不如伸长的同核有利。重要的是,缺乏任何亚型依赖性意味着单独的共聚集不能解释AD的APOE依赖性。
为了确定这些APOE-Aβ共聚集体是否与疾病相关,作者从6名AD患者死后的额叶皮层中分离出Aβ聚集体(表1)。通过浸泡温和地提取扩散聚集体,而不是组织均质,主要为不溶性纤维状的聚集体,这些聚集体大多为惰性。作者进一步使用SiMPull对三名纯合子APOE4和三名纯合子APOE3AD患者的提取物进行成像(图3A)。所有样品均产生带有或不带有APOE的Aβ聚集体,APOE4携带者的提取物比APOE3携带者的提取物含有更多的聚集体(图3B)。这一发现支持了先前的报道,即APOE4携带者比APOE3携带者具有更多的可扩散的Aβ聚集物。与作者研究的体外聚集不同的是,所有单体的聚集起始是同步的,APOE4纯合子中只有约5%的Aβ聚集物和APOE3纯合子中约1%的聚集物是共聚集物(图3C)。这种差异可能是由于共聚集体的短暂性以及Aβ和APOE在中枢神经系统中经过多年的补充和清除所导致的结果。因此,提取的聚集体反映了反应途径的广泛样本,例如原纤维附近的早期聚集物。低丰度的共聚集体与最近的观察结果一致,即短原纤维在浸脑提取液中含量丰富,并且作者发现纤维化导致APOE从共聚集体中脱落(图1)。尽管数量很少,但一些离体共聚集体很大(图3E),不同程度影响了荧光强度。通过分析蛋白质总量的结果表明,在APOE4和APOE3携带者中,共聚集体分别占a-β聚集体质量的40-60%和10-35%(图3D)。因此,这些数据揭示了在AD大脑中共聚集体的积累中存在着很大的亚型依赖性。
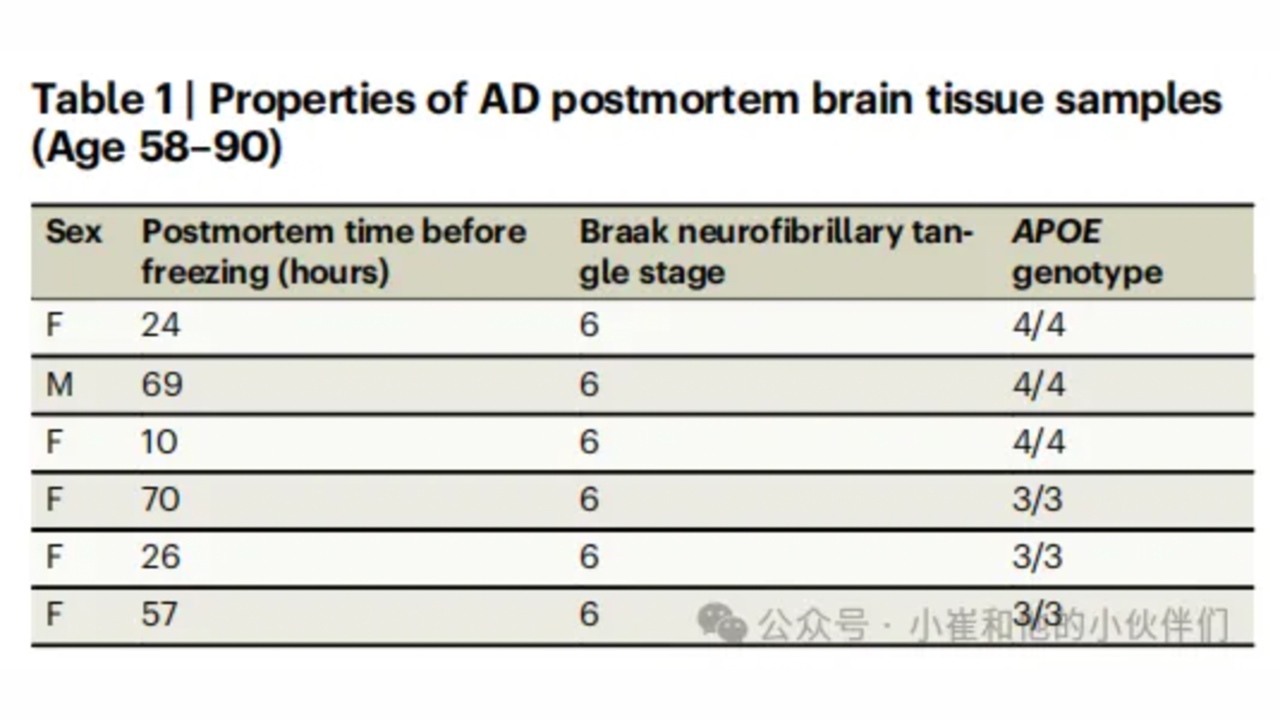
表1AD患者死后脑组织样本特征表(58-90岁)
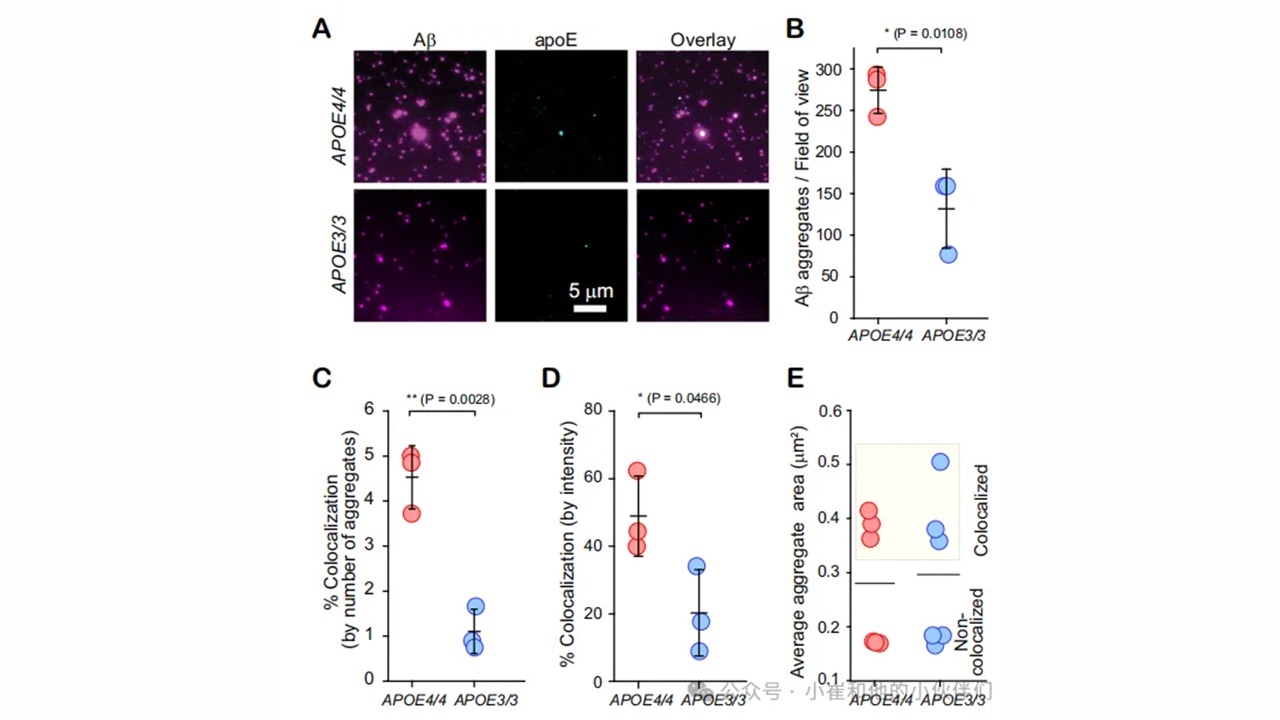
图3.Aβ-APOE共聚集体在人脑组织中形成,但其浓度具有亚型依赖性
结果2.胶质细胞摄取早期APOE-Aβ共聚集体具有脂质依赖性
考虑到APOE的所有亚型,无论脂化与否,都与Aβ42形成相似程度的共聚集体。作者接下里探索差异清除是否可以解释AD大脑中APOE-Aβ共同聚集的亚型依赖积累。通过量化两种类型的细胞对聚集体的摄取:i)人诱导多能干细胞(hIPSC)衍生的小胶质样细胞(iMGLs);ii)通过诱导神经祖细胞iNPCs(iAstrocytes)对人成纤维细胞重编程产生的星形胶质细胞(图4A-C,图S9)。先通过全转录组分析和qRT-PCR分析小胶质细胞和星形胶质细胞。人类小胶质细胞和星形胶质细胞可摄取可溶性和不可溶性的Aβ聚集物,小胶质细胞和星形胶质细胞的功能障碍与AD有关。作者将这些细胞暴露于不同时间点(t1和t3)形成的Aβ聚集体中,存在和不存在各种脂化和非脂化APOE亚型。除了监测这些细胞的总清除外,还通过分析几种促炎细胞因子和一种趋化因子来测量由此产生的炎症激活。蛋白质聚集体通过破坏中枢神经系统稳态而引起神经炎症,而已知神经毒性的Aβ聚集体可激活小胶质细胞和星形胶质细胞中的促炎通路。
作者进一步比较了iMGLs和iAstrocytes在1小时内对t1(大于等于75%共聚集体)和t3(约0%共聚集体)的早期聚集体的摄取。两种细胞类型对早期共聚集体的吸收程度都高于脂化APOE条件下制备的原纤维,而不是非脂化APOE条件下制备的原纤维(图4D,E)。无论脂化程度如何,iMGLs对早期共聚集体的吸收都具有同型特异性,但在非脂化APOE条件下,iMGLs对早期共聚集体的吸收仅在星形胶质细胞中具有同型特异性(图S10A,D)。综上所述,如果含有APOE2而非APOE4,这些细胞内化早期非脂化共聚集体的效率要高2-3倍。共聚集体的清除也高度依赖于脂化状态,早期脂化共聚集体的内化程度远高于非脂化共聚集体(图S11)。
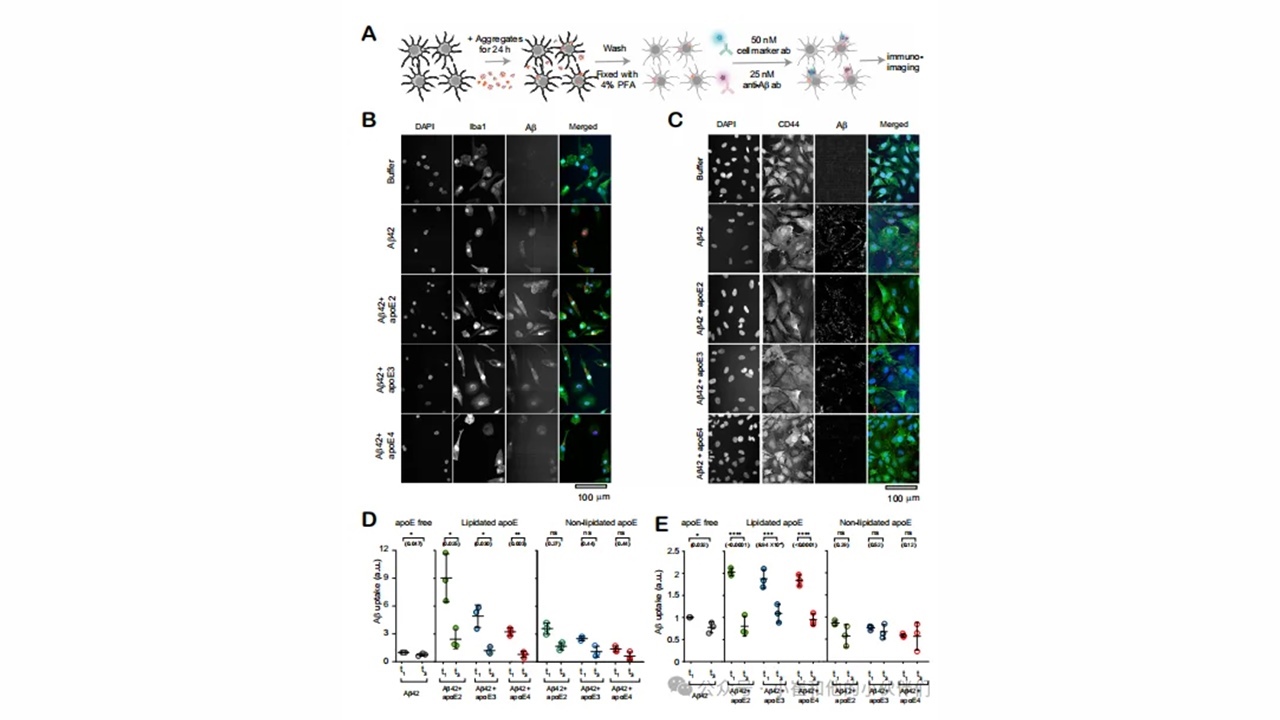
图4.胶质细胞清除APOE-aβ共聚集体取决于聚集体的成熟度、APOE亚型和脂质化情况。
为了评估胶质细胞对共聚集暴露的激活程度,作者使用酶联免疫吸附试验(ELISA)测量了促炎细胞因子白介素-1β(IL-1β)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和趋化因子单核细胞趋化蛋白-1(MCP-1)的分泌(图5A)。如果APOE不参与聚集反应或以非脂化形式存在,早期聚集物(t1)比原纤维(t3)释放的炎症标志物明显更多。然而,脂化APOE的存在将早期共聚集体的胶质细胞激活降低到与原纤维相似的水平(图5b-1)。细胞因子和趋化因子的分泌仅在非脂化共聚集体中具有显著的亚型依赖性,其促进分泌的顺序为APOE4大于APOE3大于APOE2(图S12)。神经胶质细胞的激活也依赖于APOE的脂化状态。当共聚集体在APOE非脂化形式存在的情况下形成时,它们诱导炎症标志物以更高水平释放(图S13)。单独的APOE,无论其亚型或脂化程度如何,都不会引起iMGLs或iAstrocytes的炎症(图S12I,J)。
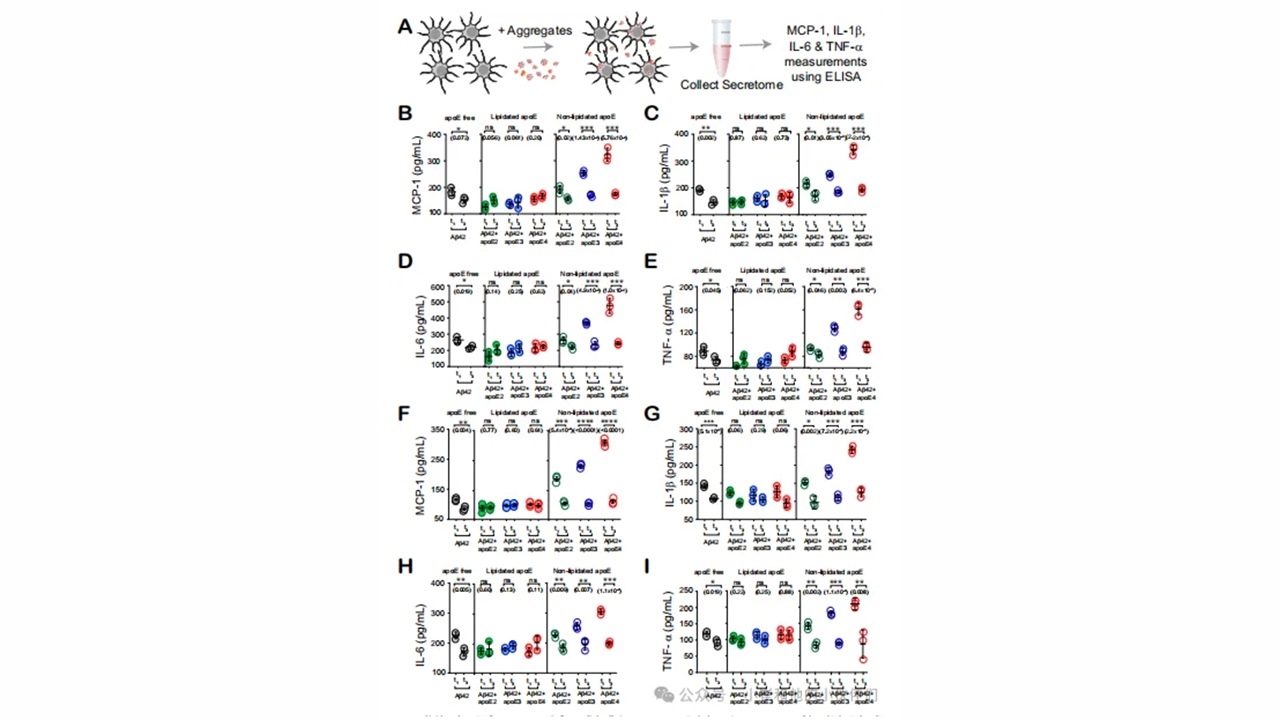
图5.早期非脂质APOE-Aβ以亚型依赖的方式共聚集炎性胶质细胞。
iMGLs和iAstrocytes对共聚集体的反应具有亚型和脂质依赖性,暗示APOE基因型与AD风险之间存在共聚集体介导的联系。在非脂化APOE存在的情况下,早期共聚集体(t1)诱导促炎细胞因子和趋化因子的分泌,但脂化增强了它们的摄取并抑制了炎症。这种模式表明早期非脂化APOE-Aβ共聚集体的作用。在研究中,预期的亚型依赖性较为明显,即非脂化APOE4-Aβ共聚集体是所有Aβ物种中清除程度最低,且最具炎症性。
结果3.早期非脂化APOE4-Aβ共聚集体具有毒性并损害胶质细胞的清除
根据先前报道,聚集的Aβ具有毒性,且其毒性取决于聚集物的大小、结构和组成。为了检查APOE是否以亚型或脂质特异性的方式调节Aβ聚集体的毒性,作者测量了Aβ在不同聚集阶段的毒性。通过两种方式分析了这种特性:i)渗透脂质膜的能力,并引起Ca2+流;ii)对SH-SY5Y细胞的毒性,导致乳酸脱氢酶(LDH)的释放(图6A,C)。相比脂化APOE,当非脂化APOE存在时,早期共聚集体比原纤维诱导更高的Ca2+内流和LDH释放(图6B,D)。
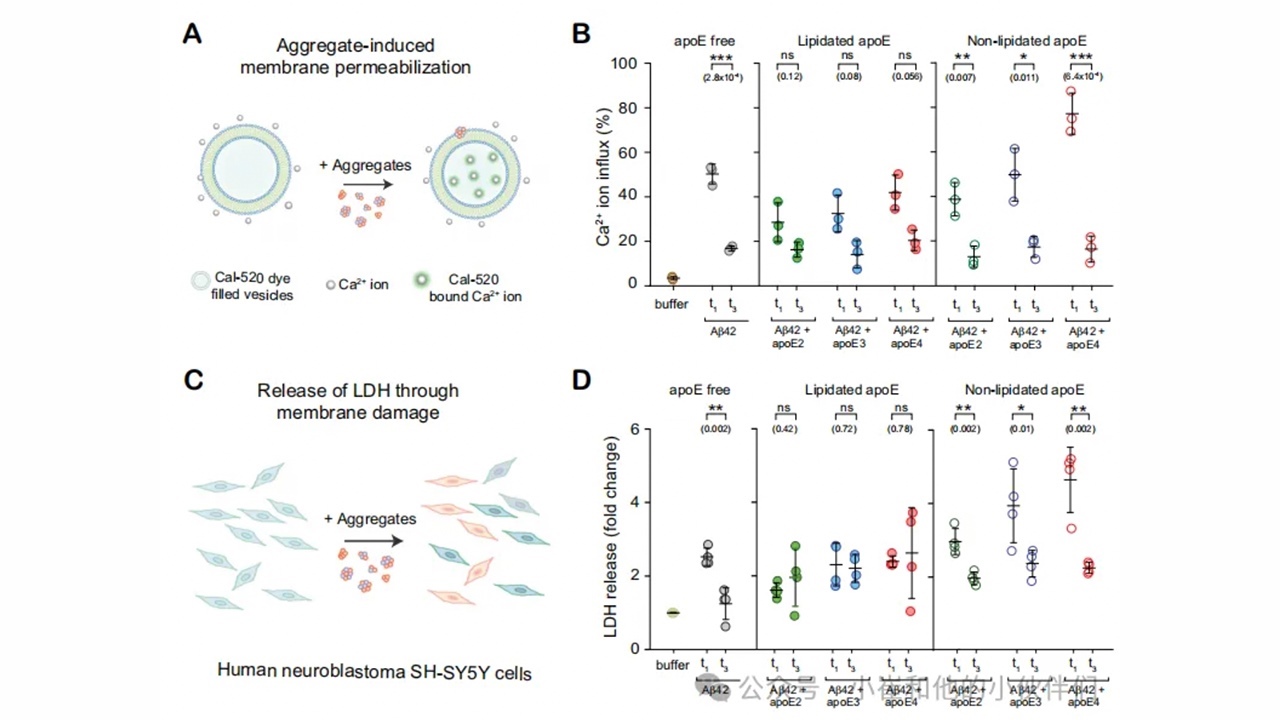
图6.APOE以亚型依赖方式调节Aβ聚集物的毒性
对于含有非脂化APOE的Aβ聚集体,其毒性具有亚型依赖(APOE4-Aβ比APOE2-Aβ毒性更大),这与摄取和细胞因子/趋化因子分泌方面的结果相一致。在没有Aβ的情况下,APOE在两种实验中均未显示出可测量的毒性(图S14C和图S15C)。与相应的脂化形式相比,非脂化的APOE4-Aβ共聚集能更有效地渗透脂膜(图S14B),并诱导更多的LDH分泌(图S15B)。在APOE2和APOE3亚型存在的情况下制备的原纤维(t3)不存在这种脂化依赖性(图S15B)。这些毒性试验描绘了一个类似的情况,早期共聚集体(t1)在脂质双分子层的渗透性更好,对神经母细胞瘤细胞的毒性比原纤维更大,并具有脂化和亚型依赖的特征。脂化共聚集体的毒性低于非脂化共聚集体,而后者的毒性依赖于同种亚型。非脂化APOE4-Aβ共聚集体对脂质膜的毒性和破坏性最大。
在确定非脂化APOE-Aβ共聚集体特别具有炎症性和毒性之后,作者进一步探索其选择性去除是否可以挽救Aβ诱导的功能障碍。为了验证这一假设,作者使用HAE-4(一种针对非脂化APOE4的抗体)和同型对照,从脂化和非脂化共聚集体的1:1混合物中免疫沉淀早期非脂化APOE4-Aβ共聚集体(图7A、B)。对混合物和上清的细胞摄取和神经炎症分析显示,去除非脂化共聚集体确实增强了Aβ的清除,减少了Aβ介导的炎症标志物(MCP-1、Il-1β、TNF-α、IL-6)在iMGLs(图7C-G)和iAstrocytes(图7H-L)中的表达。免疫沉淀的非脂化APOE4-Aβ共聚集体也减少了膜损伤(图7M)和LDH释放(图7N)。尽管总Aβ减少了50%,但去除非脂化那部分的聚集体增加了Aβ的总吸收率(对星形胶质细胞增加了50%,对iMGLs增加了100%)。然而,完全脂化的APOE4-Aβ共聚集体(图4D-E)的吸收水平远远超过脂化和非脂化共聚集体1:1混合物的两倍。这表明,与非脂化共聚集体接触引起的炎症损害了iAstrocytes和iMGLs清除脂化聚集体的能力。通过去除非脂化共聚集体来保护细胞免受这种损害,因此增加了脂化共聚集体的清除。

图7.去除非脂化APOE4-Aβ共聚集体可增强Aβ清除,减少炎症标志物的分泌和细胞毒性
结果4.在AD脑内检测到的早期APOE4-Aβ共聚集体脂化程度较低
最后,为了证实非脂化APOE共聚集体的作用,作者接着分析含有非脂化APOE共聚集体的比例。由于无法获得针对脂化或非脂化APOE3的特异性抗体,其非特异性或交叉结合程度足够低,因此这些实验仅针对APOE4/4纯合子AD患者的样本进行。使用HAE-4抗体从这些脑提取物中免疫沉淀非脂化APOE(图8A)以去除最大的共聚集体(图8B)。免疫沉淀后共定位的结果表明(图8C,D),尽管中枢神经系统中只有少数APOE是非脂化的,但在AD患者神经组织中的绝大多数共聚集体(约为80%)含有足够的非脂化APOE,足以完成免疫沉淀试验。然而,值得注意的是,由于共聚集体可以包含脂化和非脂化的APOE分子,这并不意味着共聚集体中80%的APOE为完全非脂化。
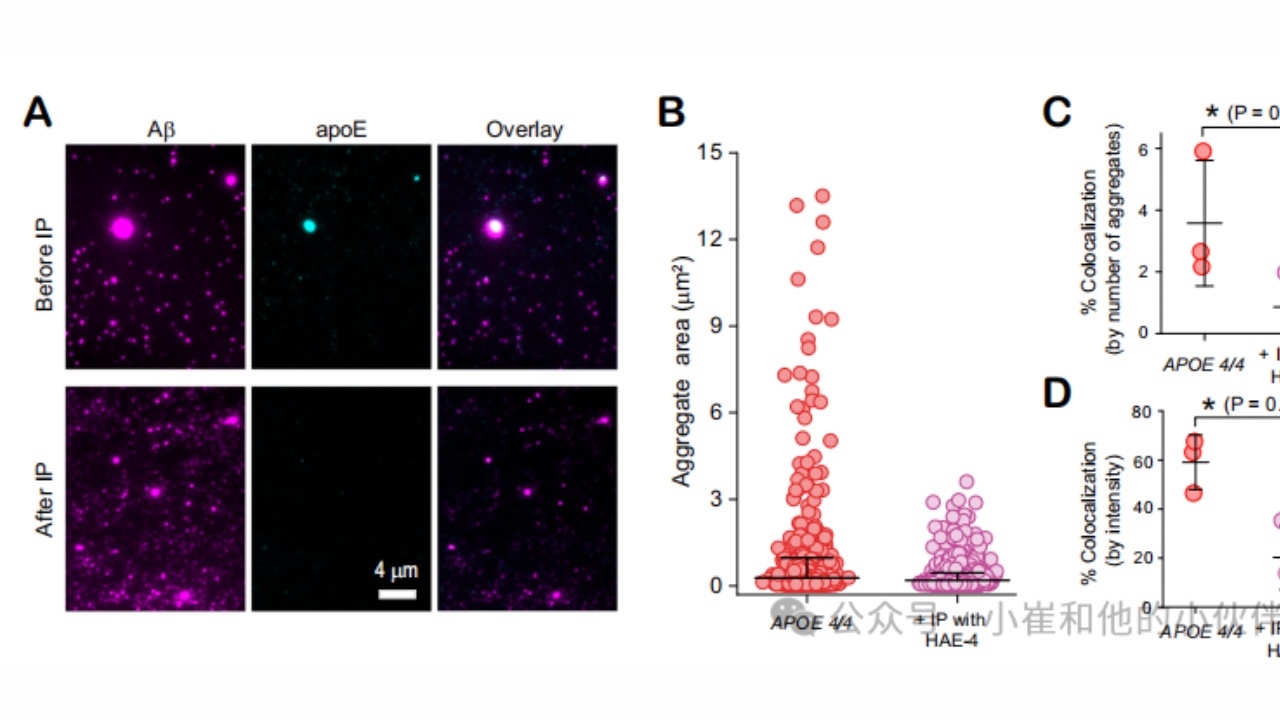
图8.APOE4/4AD患者脑内早期APOE4-Aβ共聚集体脂质化较差
小结
作者本项研究工作为后续研究和治疗晚发性阿尔茨海默病提供了新的途径。作者研究发现,去除非脂化APOE4共聚集体可减少促炎标志物的分泌,增强胶质细胞对Aβ的摄取,并保护免受Aβ诱导的膜破坏和随后的Ca2+失调。这可能形成了运用HAE-4单克隆抗体抗非脂化人APOE进行免疫治疗的分子基础。此外,作者发现共聚集体的内化和膜透性的同型依赖性相反的趋势,表明摄取可能主要由受体介导。由于APOE的受体结合能力取决于其脂化,共聚集体的脂化增强了它们的摄取。ApoE对内吞作用的影响已得到充分研究,包括其他AD危险因素,如LDL75,TREM276和PICALM77,而LRP1和VLDLR被认为是APOE-Aβ复合物运输的受体。验证在共聚集体内化中发挥重要作用的特定受体可能为精确靶向AD中的APOE提供新的思路。以不同亚型的方式调节非脂化的早期共聚集体的形成或摄取,可以消除APOE对AD特异性作用,而不会妨碍其在脂质运输中的基本功能。因为APOE4的脂化程度低于APOE2或APOE3,增强APOE脂化也可能为迟发性阿尔茨海默病提供新的干预策略,特别是对于APOE4携带者。
参考文献
XiaZ,PrescottEE,UrbanekA,WareingHE,KingMC,OlerinyovaA,DakinH,LeahT,BarnesKA,MatuszykMM,DimouE,HidariE,ZhangYP,LamJYL,DanialJSH,StricklandMR,JiangH,ThorntonP,CrowtherDC,OhtonenS,Gómez-BudiaM,BellSM,FerraiuoloL,MortiboysH,HigginbottomA,WhartonSB,HoltzmanDM,MalmT,RanasingheRT,KlenermanD,DeS.Co-aggregationwithApolipoproteinEmodulatesthefunctionofAmyloid-βinAlzheimer'sdisease.NatCommun.2024Jun1;15(1):4695.doi:10.1038/s41467-024-49028-z.
排版|里里
审核|暖暖
来源|小崔和他的小伙伴们

