
编者按:胚胎发育成一个完整且健康的婴儿是一个高度复杂和受调控过程,需要遗传密码的精确转录和翻译。染色体非整倍体带来了基因剂量的重大变化,这通常会对这一精确控制过程产生灾难性影响。事实上,非整倍体的主要影响是胚胎和/或胎儿的致死性。参与的蛋白编码基因数量越多,妊娠流产的几率就越高。今天我们就来分享张树泉老师的文章植入前和产前诊断染色体嵌合起源和临床意义。
胚胎发育成一个完整且健康的婴儿是一个高度复杂和受调控过程,需要遗传密码的精确转录和翻译。染色体非整倍体带来了基因剂量的重大变化,这通常会对这一精确控制过程产生灾难性影响。事实上,非整倍体的主要影响是胚胎和/或胎儿的致死性。参与的蛋白编码基因数量越多,妊娠流产的几率就越高。
除了少数例外,人体内的每个体细胞都应该有相同的染色体数目和结构。这一概念是基于有丝分裂错误很少发生的假设。现实中,早期细胞分裂容易出错导致染色体嵌合。染色体嵌合的临床效应直接与基因失衡的大小、初始事件的时间以及异常细胞在组织中的分布有关。在出现减数分裂错误的胚胎中通过再次染色体分离错误产生正常的细胞系,这可以被视为一种机制,通过将基因剂量回移至正常水平来减弱染色体非整倍体的致死性。相反,在染色体正常的受孕中,异常细胞系出现的越早,异常细胞所占比例就越大。在最初几次细胞分裂中发生的错误很可能表现为胚外组织和内细胞团出现异常细胞。
对于发现染色体嵌合的情况强烈建议进行遗传咨询。每种嵌合都需要根据其具体情况进行评估,并提出相应的建议。患者也应了解活产婴儿染色体嵌合风险。
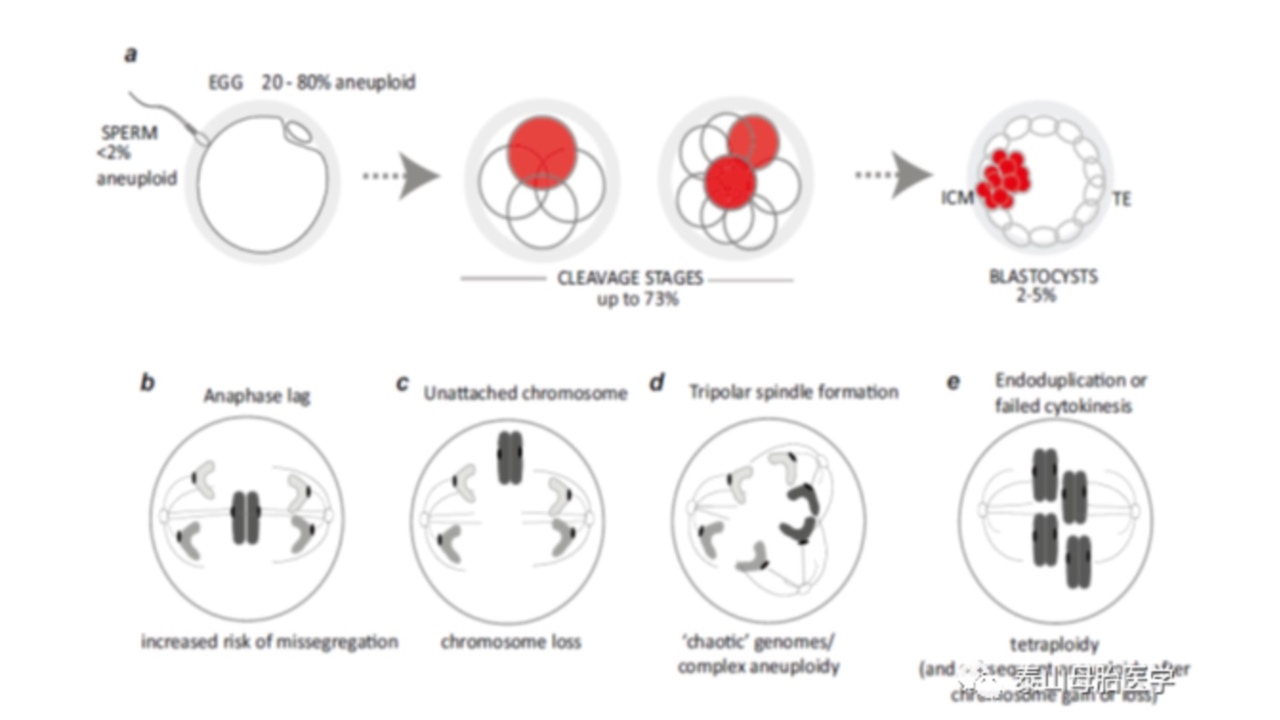
图1.人类植入前胚胎嵌合体起源。a、卵裂期和囊胚期非整倍体精子和卵子(单细胞)以及嵌合胚胎的发生率(%)。b-e,导致染色体嵌合胚胎的机制示例。b、后期延迟。c、染色体捕获失败。d、三极纺锤体形成。e、核内复制或胞质分裂失败导致四倍体细胞。
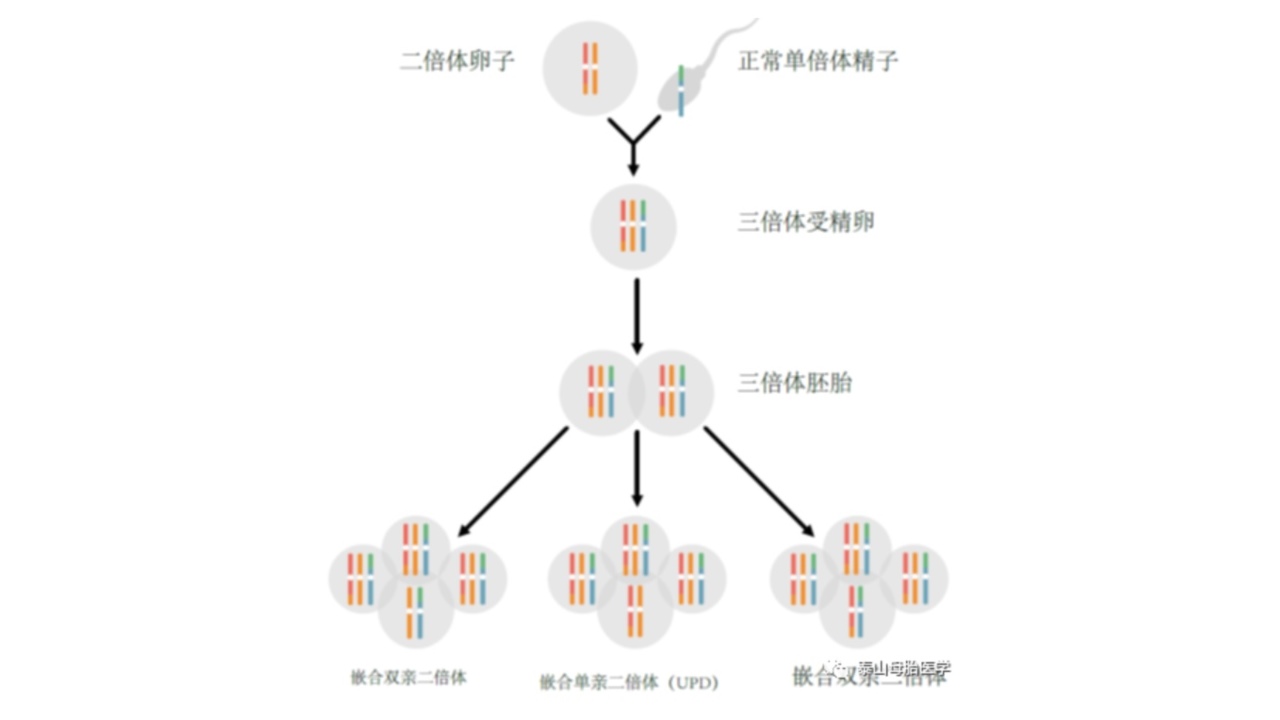
图2.三倍体拯救。图示母体减数分裂I期分离错误,产生二倍体卵子。正常单倍体精子受精产生三倍体胚胎。根据三倍体拯救过程中丢失的染色体,拯救的同源二倍体有三种可能的结果。当母体染色体在三体拯救过程中任一染色体丢失时,产生的二倍体细胞将同时包含母体和父系同源物(双亲遗传)。当父系染色体在拯救事件中丢失时,产生的二倍体同源染色体将仅来自一个亲本,即母亲(单亲二体,UPD)。在所有情况下,三倍体和二倍体细胞的嵌合体都会出现。
在胚胎分裂过程中,染色体分离的错误有多种机制。后期延迟是指在其他染色体的绝大多数姊妹染色单体分离后,染色体仍停留在中极(图1b)。
这种现象通常影响一个或只有少数染色体,并可能因姊妹染色单体复制不足,纠缠或纺锤体微管附着导致。后期延迟导致高分离错误和非互换形式的非整倍体(即染色体丢失而没有相应的染色体增加)。在某些情况下,染色体也可能无法被纺锤体捕获,人类合子的活细胞成像证实了这一现象(图1c)。
在合子分裂过程中,两个亲本的基因组被捕获在一个纺锤体上,这个过程非常容易出错。异常的三极纺锤体也会出现在着床前胚胎中,导致大量染色体丢失(“混乱”嵌合;图1d)。
它们的形成可能部分受中心体调节因子PLK4内或临近的一种常见遗传变异的影响,这种变异通过母体传递时,可能易于形成三极纺锤体。母体传递很重要,因为来自卵子的mRNAs和蛋白质驱动胚胎的最初分裂,直到胚胎基因组激活。核内复制,即染色体在不涉及细胞分裂的情况下重新复制,胞质分裂失败和中心体过度复制与四倍体细胞的形成有关(图1e)。在胞质分裂失败后某些情况下,可能导致双核细胞。人类胚胎中可出现四倍体,这会导致染色体不稳定、非整倍体和小鼠胚胎肿瘤发生。
在某些情况下,两种染色体分离错误的组合导致来自单亲遗传的一个染色体出现两个拷贝,这种现象称为单亲二倍体(UPD)。与血缘相似,单亲二倍体导致纯合子区域基因常染色体隐性疾病风险增加。UPD还可导致印记基因的异常表达(仅从父母一方的染色体表达,另一方沉默)。某些染色体含有印记区域(染色体6、7、11、14、15、20),这些染色体的UPD可导致临床异常。
文章作者:张树泉
文章来源:泰山母胎医学公众号
