
KCNT1基因编码的钾离子通道α亚基,可被胞质中的钠和氯离子激活,在神经系统中广泛表达,其突变与多种疾病相关,尤其是癫痫。近年来,大量KCNT1通道突变在癫痫患者中被发现,这些突变体通过增加通道最大开放概率或最大开放可能性等机制介导了癫痫的发生。目前,针对KCNT1功能获得性突变(gain-of-function,GOF)引发的癫痫,临床治疗效果不佳。常用的钾离子通道阻滞剂奎尼丁,在临床试验中的疗效存在争议,其对KCNT1通道的阻断效果不稳定,且部分患者无效,同时还存在其他局限性。因此,探讨KCNT1药理学特性,寻找有效且能立即用于临床的KCNT1通道阻滞剂对治疗KCNT1相关癫痫至关重要。
近日,来自徐州医科大学的张赭、唐琼瑶教授团队在ActaPharmacologicaSinica上发表了题为“ElectrophysiologicalcharacterizationofhumanKCNT1channelmodulatorsandthetherapeuticpotentialofhydroquinineandtipepidineinKCNT1mutation-associatedepilepsymousemodel”的文章。该研究克隆了新型人KCNT1B通道亚型,通过膜片钳和分子对接技术,系统评估了13种药物对其阻断作用。研究发现氢化奎宁和替哌啶对hKCNT1B通道,特别是F313L突变体有较强阻断作用,在KCNT1Y777H突变雄性小鼠癫痫模型中治疗效果显著,有望成为治疗KCNT1突变相关癫痫的药物。同时,该研究还揭示了洛沙平和氯氮平通过作用于S2上的L161残基重新激活KCNT1通道的机制。

研究人员首先克隆出hKCNT1B通道亚型,该亚型对钠的依赖性研究表明,250mM胞内葡萄糖酸钠可使其产生近似最大电流。随后,研究人员测试多种药物对hKCNT1B通道的作用。4-AP、TEA对hKCNT1B通道的阻断作用较弱,显示出与Slo1及Slo3通道不同的药理学特性;胺碘酮和苄普地尔虽能强效阻断该通道,但前者难以穿透血脑屏障,后者会阻断钠和钙通道,存在严重副作用,均限制其作为相关靶向治疗药物的临床应用。
临床研究表明,奎尼丁治疗KCNT1相关癫痫的疗效存在显著差异。为阐明这一现象,本研究利用膜片钳技术系统评估了奎尼丁对KCNT1通道不同结构域上癫痫相关突变的抑制作用。结果显示,奎尼丁对hKCNT1B通道的阻断作用较弱,且不同突变体对其敏感性差异较大,对G255S、K596N、G619V、M863K、R917Q等突变体具有较好的阻断效果,对Q237E、R365Q、R395Q、Y763H的阻断效果则相对较差,尤其是F313L突变体对奎尼丁表现出一定的抗性。这一发现为奎尼丁在临床试验中疗效的不一致性提供了重要的分子机制解释。
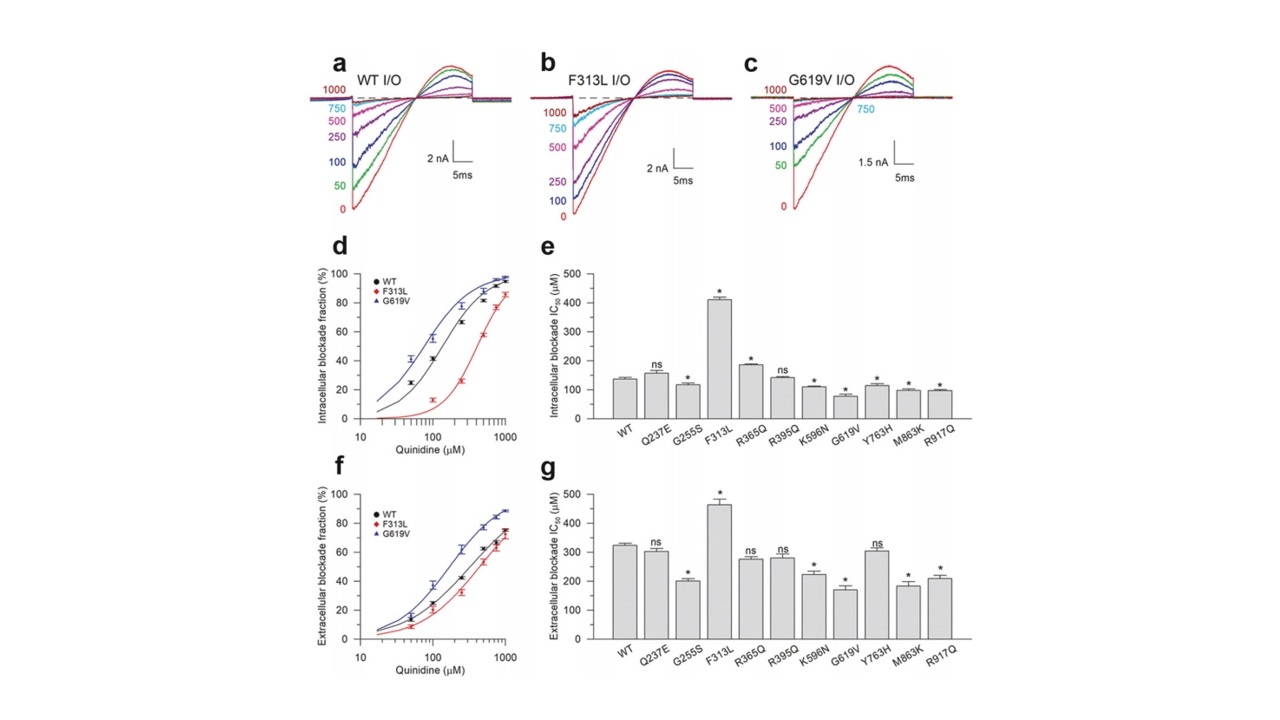
图1:奎尼丁对hKCNT1B通道的阻断作用较弱,且不同突变体差异较大
奎尼丁作为金鸡纳生物碱家族的代表性化合物,在研究过程中发现其对hKCNT1B通道的阻断作用相对较弱。进一步研究表明,氢化奎宁在细胞膜内外对野生型和F313L突变体均表现出更强的阻断作用。通过分子对接分析发现,金鸡纳生物碱家族化合物均具有疏水性特征,其作用机制主要是通过与通道孔域内衬的疏水性氨基酸残基形成疏水相互作用,从而阻塞通道孔域并阻止钾离子内流。值得注意的是,在四种化合物中,氢化奎宁的疏水性最强(XLoP3.1),其与孔域内部氨基酸残基的结合自由能最低(-7.3kcal/mol),这表明氢化奎宁与通道的亲和力最高,这可能是其表现出更强阻断作用的结构基础。
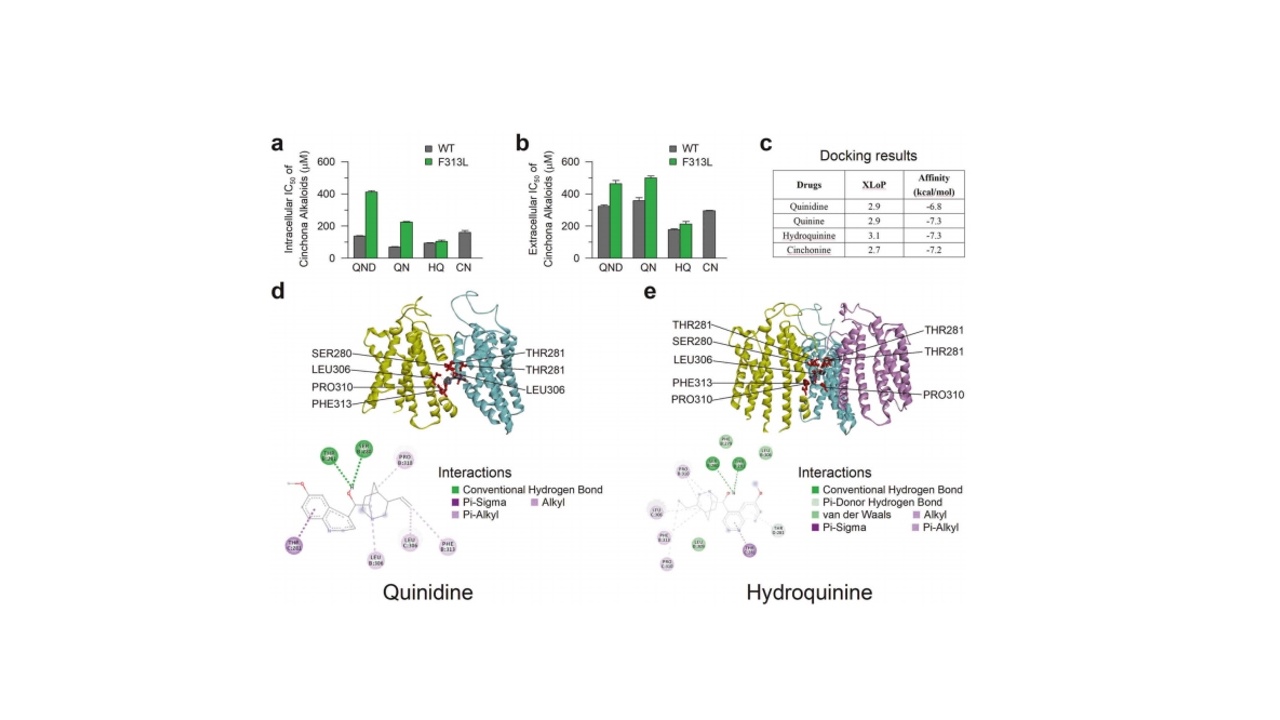
图2:氢化奎宁通过与孔域内衬的疏水性残基形成疏水相互作用阻塞通道
此外,针对非麻醉性镇咳药替哌啶对KCNT1通道表现出独特的浓度依赖性抑制作用。实验数据显示,该药物在6μM浓度时即可抑制50%的最大通道电流,呈现出显著的阻断效应,这一浓度远低于其临床相关血浆浓度(108μM,2mg/kg)。值得注意的是,当药物浓度提升至25μM以上时,其抑制效应达到平台期,最大抑制率稳定在75%-80%之间,表现出典型的饱和动力学特征。分子对接进一步阐明了替哌啶的作用机制:其分子结构中的疏水基团与通道孔域内衬的疏水性残基形成特异性疏水相互作用,从而堵塞通道孔域阻断通道电流。这种独特的浓度-效应关系赋予了替哌啶双重优势:一方面,通过适度降低通道兴奋性发挥抗癫痫作用;另一方面,其抑制效应的自限性特征避免了过度阻断可能引发的焦虑等不良反应,从而展现出较宽的治疗窗和良好的临床应用前景。
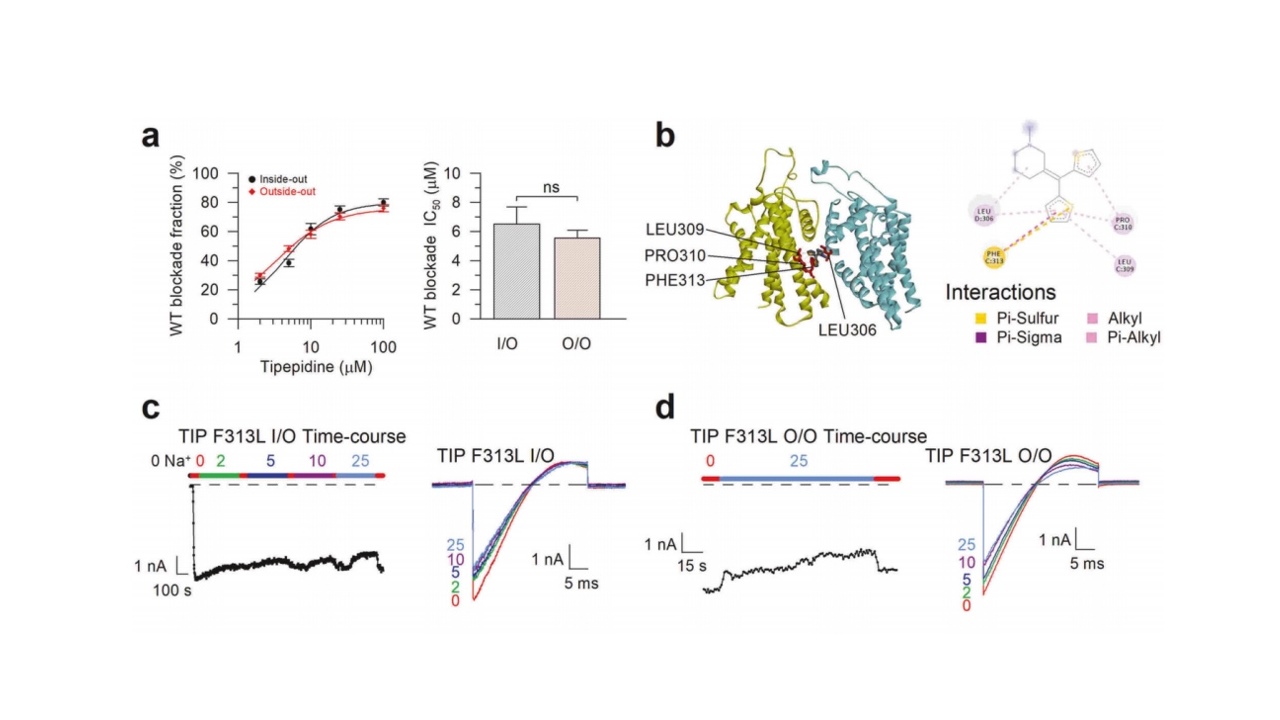
图3:替哌啶以较低的浓度显著抑制通道电流,并表现出饱和动力学特征
为进一步验证氢化奎宁和替哌啶的治疗效果,研究团队采用Y777H突变的雄性小鼠模型开展了系统的药效学评价。实验结果显示,单次给药后,两种化合物均能显著改善模型动物的癫痫表型。通过视频监控,行为学评估表明Y777H小鼠自发性癫痫发作评分显著显降低;EEG监测发现,特征性的尖峰波放电(SWD,大于200μV)占比明显下降;同时,氢化奎宁和替哌啶两种药物的干预均显著降低了癫痫发作频率。值得注意的是,两种药物联合使用时,与单独给药相比,并未展现出更显著的效果或明显差异,这可能归因于两种药物竞争性结合孔域内部结合位点。

图4:氢化奎宁和替哌啶显著改善Y777H癫痫小鼠癫痫症状
深入探究激活剂对于解析通道的门控机制意义非凡。在本研究中,科研人员发现,当KCNT1通道处于部分开放状态(细胞内环境为150mMNa+)时,洛沙平(loxapine)和氯氮平(clozapine)能够在不改变通道对钠离子依赖性的情况下,凭借疏水相互作用与通道S2段上的L161残基紧密结合。这种结合通过别构效应进一步稳定了通道的开放构象,部分逆转了通道电流的衰减(run-down)。该发现为阐释通道激活剂的作用机制提供了全新的视角与理论依据,对深入理解离子通道的门控机制具有重要的科学意义。
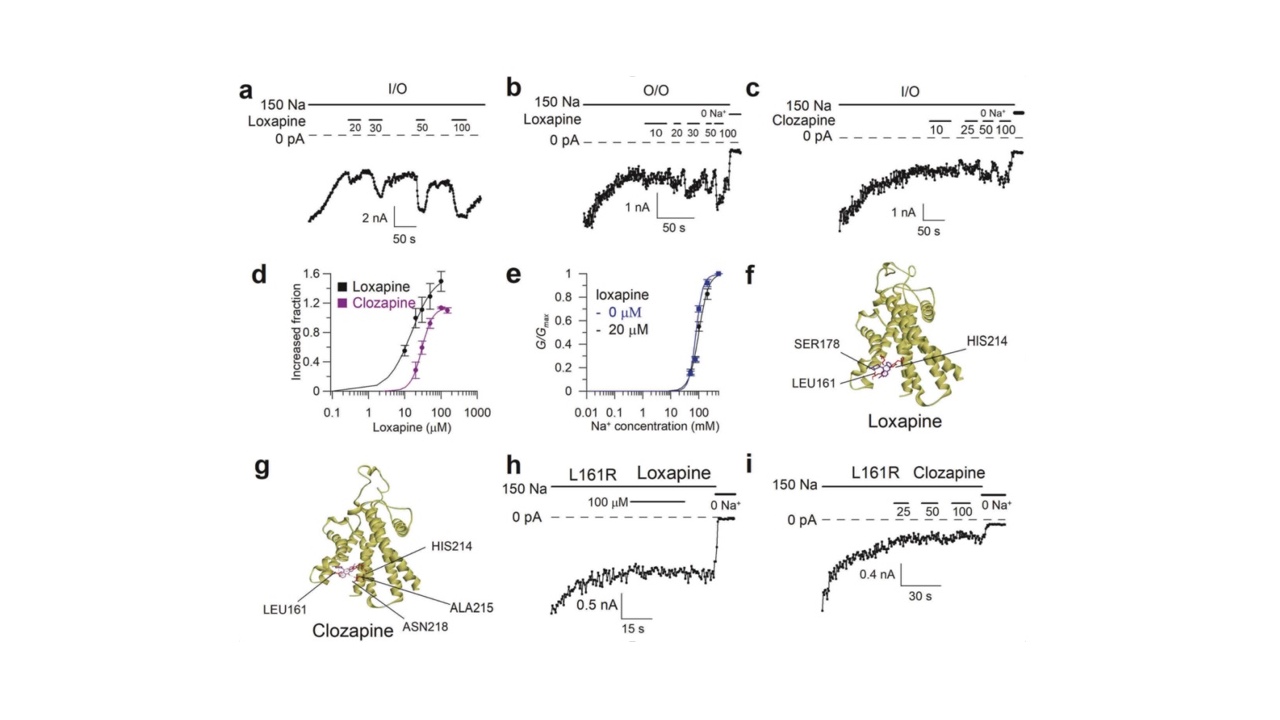
图5:洛沙平和氯氮平通过别构效应部分逆转通道电流的衰减
文章结论与讨论,启发与展望
本研究在KCNT1通道调节剂领域取得了重要突破。通过系统性筛选和评估多种药物,研究首次揭示了hKCNT1B通道与BK通道家族其他成员在药理学特性上的显著差异,并发现氢化奎宁和替哌啶在治疗KCNT1突变相关癫痫方面展现出良好的应用前景,为开发精准化抗癫痫治疗方案提供了新的思路。此外,该研究阐明了洛沙平和氯氮平激活KCNT1通道的具体分子作用机制,为深入理解通道门控机制提供了重要理论依据。然而,本研究仍存在一定局限性:首先,受限于研究条件,目前仅通过动物实验初步验证了氢化奎宁和替哌啶的疗效,其临床治疗的有效性和安全性仍需大规模临床试验进一步证实;其次,现有电生理实验和分子模拟结果多为间接证据,建议后续研究可采用冷冻电镜技术,以更直观地解析药物与通道蛋白相互作用的分子机制。这些发现不仅推动了KCNT1通道调节剂领域的研究进展,也为相关药物的临床转化奠定了重要基础。
原文链接:https://doi.org/10.1038/s41401-024-01457-8
排版|麦麦
审核|梓霖
来源|逻辑神经科学

