
细胞内钙离子信号稳态是生命活动的关键步骤,受到严格调控。越来越多的证据表明钙离子信号紊乱是阿尔茨海默病(AD)和其他类型的痴呆症的关键病理事件。钙离子信号紊乱主要发生在AD早期,临床症状出现之前,可诱发突触功能障碍。胞质内钙离子浓度增加可促进淀粉样β蛋白斑块(Aβ斑块)和tau蛋白病变,Aβ斑块病变也会增加胞质内钙离子浓度。
机体主要存在三类介导钙离子从胞外进入胞内的钙离子通道:受体控制的钙离子通道、电压依赖式钙离子通道(VGCC)和钙池操纵性钙通道(SOCC)。一般来说,进入到细胞内多余钙离子主要集中在内质网,在胞浆内钙离子下降后,内质网主要通过钙池操纵性钙内流(SOCE)方式增加胞内钙离子浓度。
2024年5月31日比利时Bio-Incubator科技公司GerardGriffioen团队在Science杂志上发现了维持钙离子稳态的小分子骨架蛋白ReS19-T可通过降低胞内钙离子浓度,显著改善AD的核心病理病变。

研究人员通过模拟Tau蛋白和钙离子引起的神经毒性的细胞筛选平台,发现一类可显著恢复胞内钙离子浓度的化合物ReS19-T,其中REM127效果最好。β淀粉样蛋白(Aβ)衍生的可扩散性配体(ADDLs)可引起tau蛋白磷酸化和持续的胞质内钙离子浓度升高,REM127可逆转ADDLs引起的突触丢失和胞质内钙离子浓度升高。
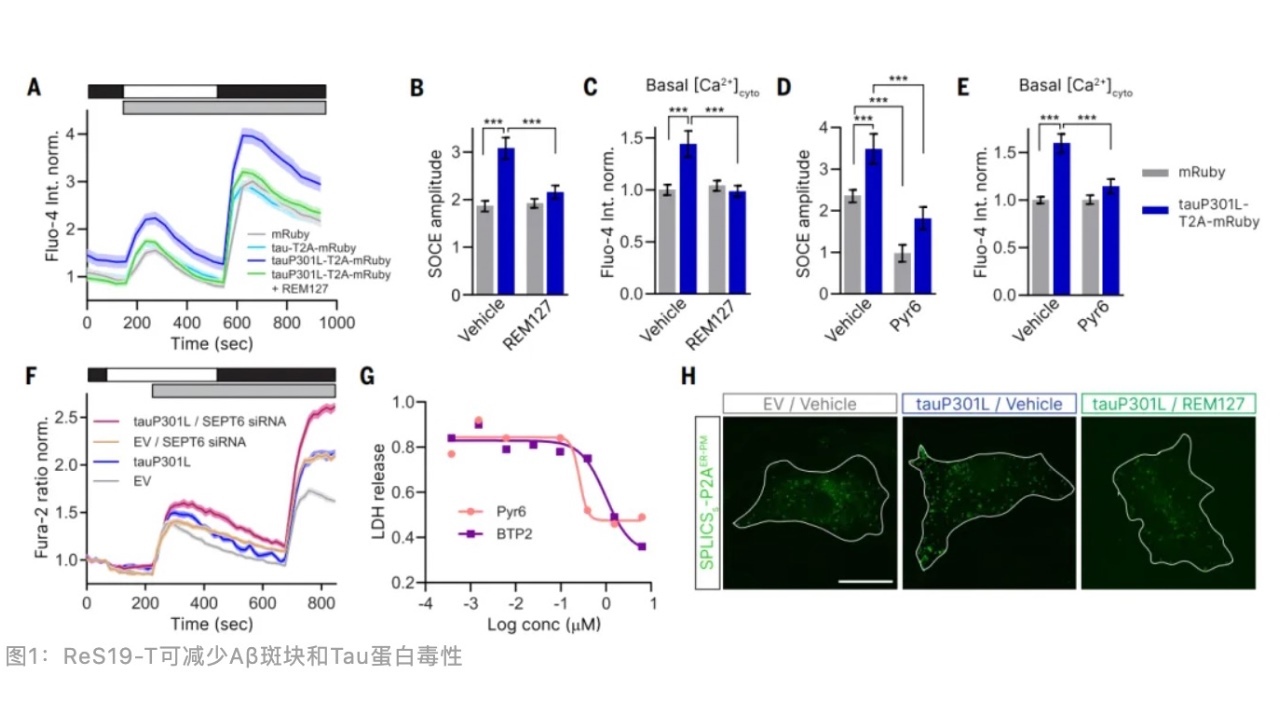
进一步通过分子互作筛选出与REM127密切互作的分子是隔膜蛋白6(SEPT6),是一种高度保守的鸟苷5′-三磷酸(GTP)结合蛋白,作为细胞骨架成分与SEPT2和SEPT7家族成员一起组装成细胞微丝,也是SOCE关键的调节因子。敲低SEPT6可部分阻断REM127的神经保护作用。
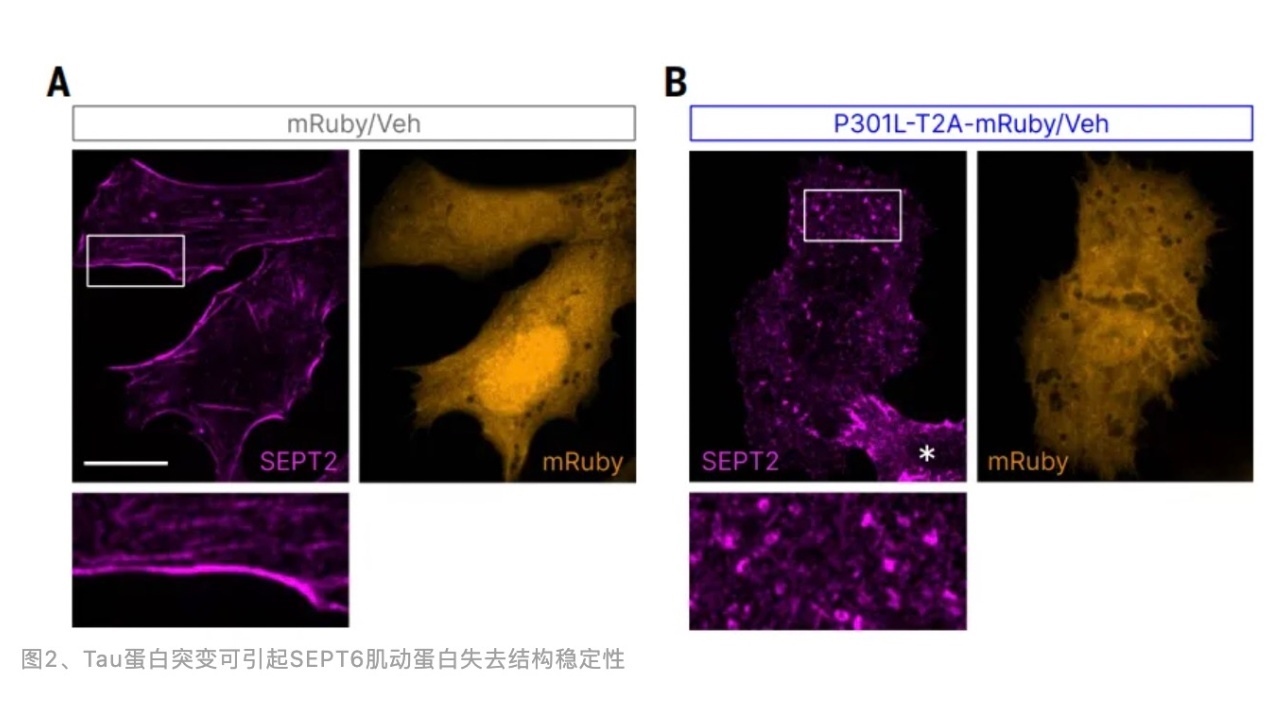
离体实验证实Tau蛋白突变后引起胞质内钙离子浓度升高,SOCE幅度增加,REM127和SOCC抑制剂Pyr6均可阻断上述现象的发生。SOCE主要在内质网膜和细胞质膜接触位点处被激活,Tau蛋白突变可扩大这个接触位点的面积,REM127可缩小接触位点的面积。结构生物学分析发现REM127可影响SEPT6肌动蛋白的稳定。
离体细胞实验表明Tau蛋白突变可引起SEPT6肌动蛋白大面积的重构,失去结构稳定性,而REM127可显著恢复这种结构失稳。因此,Tau蛋白突变可引起SEPT6肌动蛋白结构失稳,增加内质网膜和细胞质膜接触位点面积,激活SOCC通道引起钙离子内流。
TauP301S转基因小鼠(Tau蛋白突变)和APP-Ln模型小鼠海马脑区存在严重的长时程增强障碍,7天口服REM127可明显缓解上述突触可塑性障碍,并能改善空间学习记忆障碍。接受3个月的REM127可减少50%的APP-Ln模型小鼠皮层和海马Aβ斑块沉积,也能减少APP-SAA(另外一种AD模型小鼠)小鼠海马的Aβ斑块沉积和Tau蛋白聚集,也能降低磷酸化Tau蛋白水平,这些结果表明REM127可显著改善AD模型小鼠的核心病理事件。
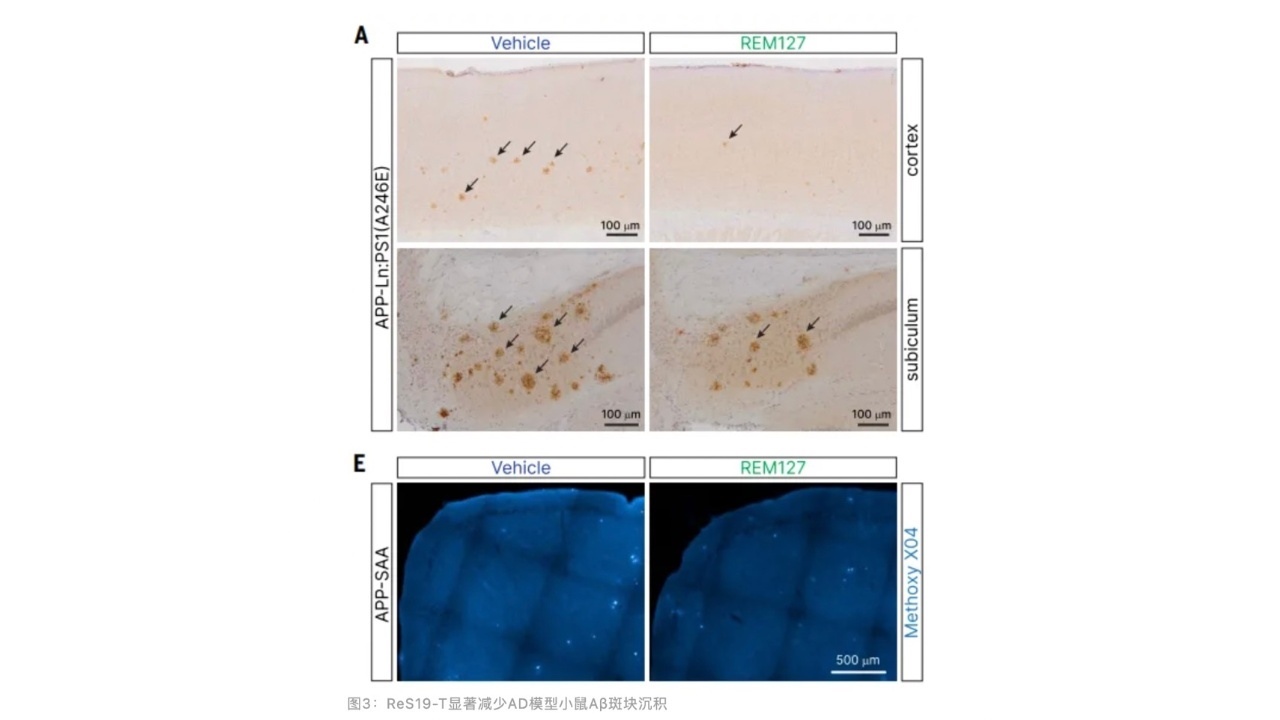
本文发现了一类具有潜在治疗AD的蛋白ReS19-T,可通过恢复SEPT6肌动蛋白结构稳定性,减少内质网膜和细胞质膜接触,抑制SOCC通道,减少钙离子内流,并能显著减少AD模型小鼠Aβ斑块沉积和Tau蛋白异常积聚。
以上文章来源于神经周K,作者神经周刊

