瘤声机| 浙江大学医学院附属第二医院妇科学术交流会
1988年,美国癌症学会(ACS)首次在TBS提出“非典型腺上皮细胞(AGC)”。2014年Bethesda系统(TBS)中,腺上皮细胞异常具体分为四种:①非典型腺细胞,无特指(AGC-NOS);②非典型腺细胞,倾向瘤变(AGC-FN);③子宫颈管原位癌(AIS),与高级别鳞状上皮内病变(HSIL)对应;④腺癌(AC),与鳞状细胞癌(SCC)对应。近年来,细胞涂片诊断出腺细胞异常的比例呈上升趋势,数据显示,AGC占所有宫颈涂片的0.18~0.74%,占所有巴氏涂片的2.5%。浙江大学医学院附属第二医院马炯副主任医师结合相关文献对HPV相关AGC与腺癌的临床特征进行探讨和解析。
一、HPV相关AGC
(一)AGC的源起
非典型子宫颈管腺细胞(AGC)的细胞核变化程度明显超出反应性和修复性改变,缺乏明确的子宫颈管原位腺癌特点,缺乏明确的子宫颈管侵袭性腺癌特点。其来源于反应性、修复性、宫颈息肉、输卵管上皮化生、子宫下段内膜细胞、高位宫颈管腺细胞、微腺体增生、产后非典型性、A-S反应、宫颈原位腺癌和浸润性癌、转移性腺瘤、鳞癌、HSIL累及腺体。需要进一步确定是否倾向于肿瘤。
关于AGCs起源于内膜腺细胞、宫颈管腺细胞,ShinjiToyoda等对1254例AGC的判读中认为,24%来自子宫内膜,76%来自宫颈。不同文献对AGC报告的阳性率报道差异很大,多数文献报道AGC占子宫颈阴道细胞学涂片的0.1~2.5%,一般<1%。美国病理学家协会(CAP)细胞学实验室评审报告中的AGC阳性报告值为0~0.8%,中间值为0.1~0.2%。
(二)AGC的特点
与鳞状病变相比,巴氏涂片对评估腺源性上皮细胞异常的敏感性较低,但它们通常用于鉴别诊断高级别鳞状细胞病变(HSILs)和核浓染的拥挤腺体(HCG)。
AGC的细胞组织相关性:约30%的AGC是高危HPV(hrHPV)阳性;在细胞组织相关性方面,约15%与LSIL或HSIL相关;1%与AIS相关,0.5%与腺癌相关。
AGC的判定非常具有挑战性,不同细胞学医生的重复性较低。细胞学医生和Bethesda专家小组比对研究显示,AGC的判定只有33%一致。
(三)AGC与HPV
2022年,Cytojoumal上发表的《HPV检测和分型的作用》显示:①大多数宫颈腺病变与16型、18型和45型HPV相关,年轻女性(<40岁)HPV阳性的可能性高于老年女性(>60岁),其他hrHPV类型包括HPV31、33、35、39、51、52、56、58、59、66和68。②一些腺癌的hrHPV阴性,HPV阴性腺癌包括大多数子宫内膜癌、透明细胞癌、高级别浆液性癌、中肾腺癌和其他部位的腺癌。③目前没有关于在巴氏涂片中检测hrHPV并进行AGC解释的指南,在伴有鳞状病变的AGC组中,HPV更有可能呈阳性,而在伴有非典型子宫内膜细胞的病例中,HPV阳性率较低。因此,与HPV阴性患者相比,AGC组HPV阳性患者的临床显著病变检出率更高,阴性预测值为99.2%。
2022年发表在AJCP上的《细胞学诊断和高危人乳头瘤病毒在伴有和不伴有鳞状细胞异常的非典型腺细胞的Pap试验中的联合检测》显示:①年龄中位数为44岁,单纯AGC组的中位年龄明显高于ACG+Sq组(48岁vs35岁)。②单纯AGC组以AGC、NOS为主,而AGC+Sq组以AGC、宫颈内型为主。③AGC+Sq组的阳性率为55%,明显高于单独AGC组14%(P<0.0001);两组中大多数HPV阳性病例均为非16/18型HPV(AGC+Sq组为62%,单独AGC组为63%);两组间HPV型别分布差异无统计学意义。即AGC伴有鳞状细胞异常时HPV阳性率更高。
一项评估不同HPV类型对AGC女性宫颈和子宫内膜病变风险的影响的多机构回顾性研究显示:①在HPV阳性患者中,发生病变的风险为33.8%;②HPV阴性患者中,发生病变的风险为15.5%;③诊断为HPV16的患者发生宫颈病变的风险更高(p<0.01);HPV18、31、33和45的存在并没有增加发生病变的风险(p>0.2);④HPV阳性患者在检测到AGC后6个月内被诊断为宫颈病变的风险较高。
2022年一篇纳入885例AGC的瑞典妇女、随访2年的队列研究显示:①HPV16/18+的CIN3+累积风险为80%(95%CI:74-86%),②“其他HPV”+的CIN3+累积风险为58%(95%CI:50-60%),③HPV-的CIN3+累积风险为10%(95%CI:5-18%),④HPV16/18+的AGC妇女2年累积浸润癌风险为17%(95%CI:12-24%)。也就是说,关于细胞学AGC,HPV16/18阳性妇女CIN3+的累积发病率最高,其中一半以上的妇女在随访的第一年被诊断为CIN3+;HPV阴性AGC后正常或轻度/中度组织病理学的比例>95%,“其他HPV”AGC后正常/轻度/中度组织病理学的比例约为HPV16/18AGC阳性两倍;HPV16/18阳性AGC的2年浸润性宫颈癌累积发病率为17%,而“其他HPV”和HPV阴性AGC的2年累积发病率均为2%。
(四)AGC与CC
2016年的一篇BMJ文献显示,AGC女性宫颈癌患病率为1.4%,低于HSIL女性(2.5%),高于LSIL女性(0.2%),而腺癌占AGC相关流行病例的73.2%。该研究还显示:AGC后浸润性宫颈癌的发生率显著高于细胞学检查正常女性,持续时间长达15.5年,高于HSIL和LSIL,持续时间长达6.5年;AGC后第一轮筛查中,腺癌的发病率比细胞学结果正常女性高61倍,15.5年时间里保持9倍高;浸润性宫颈癌的发病率和患病率在30~39岁年龄段最高,只有54%的AGC女性在6个月内进行了组织学评估,远低于HSIL后的86%,在6个月内进行组织学评估的女性中,AGC后宫颈癌的发病率显著高于HSIL后6.5年的发病率。
2021年CancerEpidemiolBiomarkersPrev.中一篇纳入8537385例细胞学涂片和9061例癌症研究结果显示:建议重复细胞学检查时,年轻女性的宫颈癌的HR为6.91(5%CI,5.48~8.71),老年女性的HR为3.98(95%CI,2.38~6.66)或其他妇科癌症诊断的年轻女性(HR,2.82;95%CI,1.39~5.74);与鳞状细胞异常相比,基于AGC的异常显著高于基于鳞状细胞异常,除了老年妇女的宫颈癌外,“转诊”细胞学建议的风险也显著更高(HR,0.88,95%CI,0.63~1.21)。
(五)AGC与CC/ASCCP
1、2019ASCCP
(1)对于AGC和AIS所有亚类别的所有年龄的非妊娠患者,除非有非典型子宫内膜细胞,无论HPV检测结果如何,都建议进行阴道镜检查,除妊娠外,初次阴道镜检查时推荐宫颈内取样。
(2)对于年龄在35岁或以上的所有类型的AGC和AIS的未怀孕患者,建议子宫内膜取样与阴道镜和宫颈内膜取样一起进行。根据临床适应证(如子宫异常出血、慢性无排卵或肥胖),35岁以下未怀孕且子宫内膜瘤变风险增加的患者也推荐子宫内膜试验取样。
(3)对于特定的非典型子宫内膜细胞的患者,首选初始评估仅限于子宫内膜和宫颈内膜取样,初始评估时可接受阴道镜检查。如果阴道镜检查推迟,没有子宫内膜病理确定,则建议使用阴道镜检查进行额外的评估。
2、AGC与CC(2020JournalofLowerGenitalTractDisease)
AGC是一种重复性差的诊断类型,HPV检测结果阳性,特别是当HPV18型阳性时,可能表明CIN2+病变的风险较高。因此,无论HPV结果如何,阴道镜检查都是推荐的。
细胞学AGC结果与组织学诊断AIS相关的比例为3%-4%,CIN2+的比例为9%,浸润性癌症的比例为2%~3%。
在KPNC数据中,HPV阳性AGC(所有类别)即刻CIN3+风险为26%,HPV阴性AGC即刻CIN3+风险为1.1%。
HPV阳性AGC类型的肿瘤或腺癌具有55%的即时CIN3+风险,而其他HPV阳性AGC类型的即时CIN3+风险约为20%。
绝经前子宫内膜癌的患病率正在增加,强调子宫内膜取样的重要性。
二、HPV相关宫颈腺癌
宫颈腺癌是一组异质性肿瘤,将宫颈鳞癌癌前病变筛查策略应用于腺癌癌前病变时效果较差。根据美国和欧洲的研究,由于鳞癌筛查成功等原因,宫颈腺癌的实际和相对发病率近年来从5%增加到20%~25%,特别是30岁以上的患者。大多数宫颈腺癌与HPV相关,最常见的是HPV18、16和45。与宫颈鳞癌不同的是,约15%的宫颈腺癌与HPV无关,此亚型与HPV相关性腺癌存在明显不同的分子基础。
(一)分类
在国际宫颈腺癌标准和分类(IECC)系统、WHO分类、Silva分类、FIGO分期、TNM分期等宫颈腺癌的分类和分期方法中,临床常用IECC分类和FIGO分期。
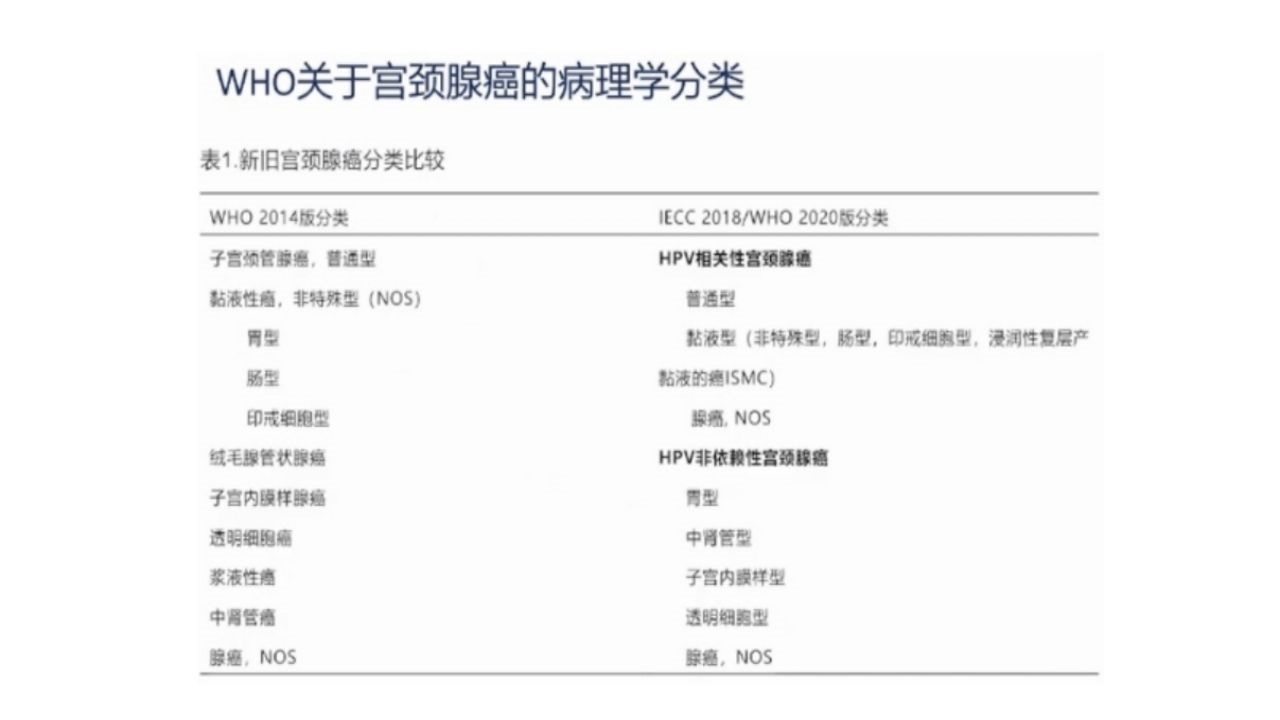
1、IECC2018/WHO2020分类
IECC2018/WHO2020分类根据是否HPV相关将宫颈腺癌分为不同类型,将临床特征、p16表达、HPV状态、预后、生存和治疗反应相关列入;具有优越的观察者间可重复性,并与HPV状态高度相关;HPV非依赖性腺癌预后远差于HPV相关性腺癌。
2、IECC系统的基础
(1)HE染色玻片:40-100倍视野下识别核分裂象和调亡小体。
(2)HPV相关性腺癌:在40-100倍视野看到容易识别的核分裂象和调亡小体。前期病变包括普通型原位腺癌(AIS)、复层产黏液的上皮内病变(SMILE)。
(3)HPV非依赖性腺癌:当核分裂象和调亡小体在高倍镜下未见或难以发现。胃型腺癌的前期病变,可见非典型小叶性宫颈腺样增生(LEGH)、胃型原位癌(gAIS);部分中肾管型腺癌起源于中肾管增生。
(4)HPV相关性和HPV非依赖性的宫颈腺癌亚型分类:是否明显存在胞浆内黏液、肿瘤结构模式。
(5)均存在腺癌,NOS。
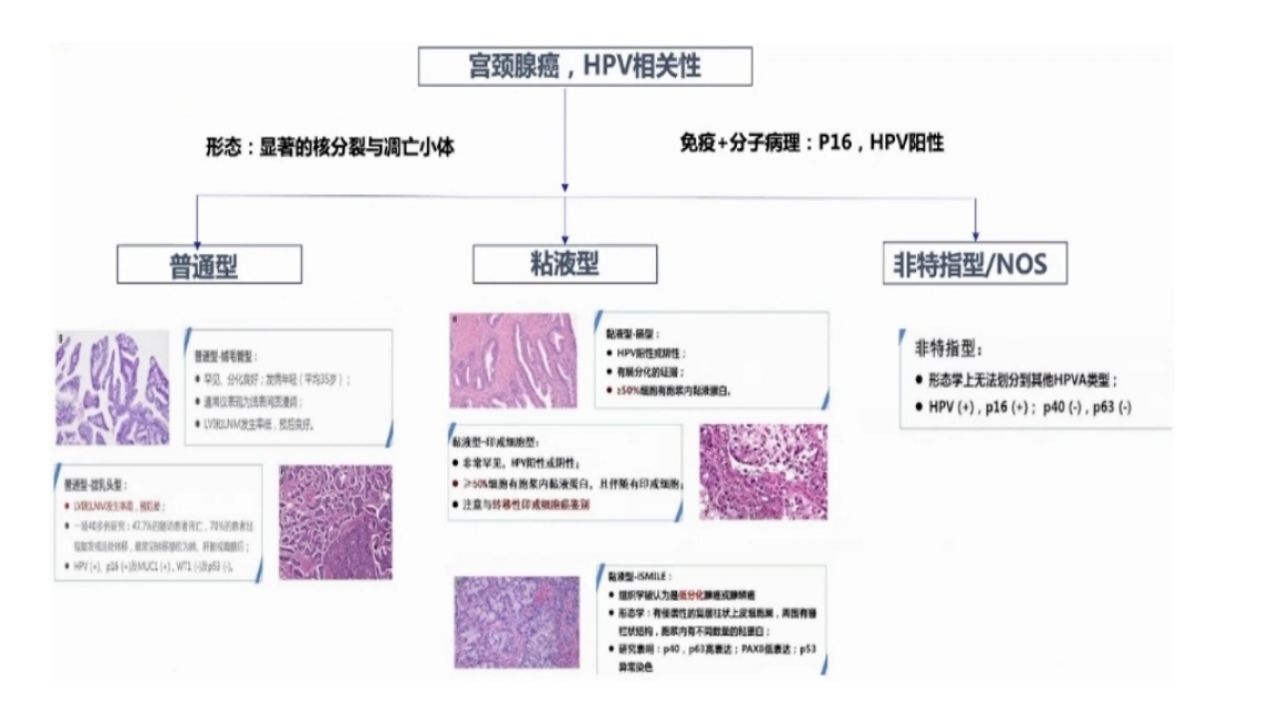
3、HPV相关宫颈腺癌
4、非HPV相关宫颈腺癌
大多数西方国家,HPV非依赖性宫颈腺癌约占所有宫颈腺癌的15%,东亚地区胃型肿瘤发病率相对较高,因此该比列可能高于西方国家。非HPV相关性宫颈腺癌的发病年龄更大,肿瘤直径更大,临床分期更晚,LVI、LNM发生率更高,更倾向于SilvaC模式,OS/DFS/PFS更差,辅助治疗反应更差。
(二)宫颈腺癌
Xie等关于宫颈腺癌诊断前6个月内接受细胞学和/或HR-HPV检测的患者的研究显示,细胞学检查和HR-HPV联合筛查提高了原发性宫颈腺癌的筛查效率。
1、普通型宫颈腺癌,HPV相关
·最常见的宫颈腺癌类型,占所有宫颈腺癌的75%~80%。
·肿瘤内部含黏液细胞的比例<50%。
·肿瘤结构模式变异类型:A.绒毛腺管状(预后较好);B.微乳头状(预后差);C.乳头状;D.筛状,似子宫内膜样癌;E.囊状
·鉴别:宫颈、宫体子宫内膜样腺癌、转移性浆液性癌、腺鳞癌或伴有鳞状分化的子宫内膜样腺癌。
·免疫组化及分子病理:P16通常弥漫强阳性,HPVRNA原位杂交阳性;ER、PR、vimentin、MUC6、HNF1β、NapsinA、GATA3、AR和HER2阴性;p53通常野生型。
·Silva分型适用于HPV相关性普通型宫颈腺癌,分为A、B、C型,对患者的预后及治疗方案有重要的提示意义。相关研究表明:①原位腺癌和A型浸润性病变可分为具有非破坏性生长的宫颈内膜腺癌,其预后良好,无淋巴结扩散风险;排除了破坏性浸润,但很难区分原位入侵和模式A时,可以统称“非破坏性生长的宫颈内膜腺癌”,这类病例可能适合保守管理;②破坏性的肿瘤生长形式,无论是局灶性(模式B)还是弥漫性(模式C),与淋巴结扩散率和不良结果有关,应考虑更积极的治疗。一项基于silva的模型来预测中危AC患者复发特异性的研究显示,基于Siva的模型,四个中等危险因素中的任意三个(SilvaC,肿瘤大小≥3cm,DSI>2/3,LVSI>轻度),表现出最好复发预测效果,超过了Sedlis标准。
2、黏液型宫颈腺癌,HPV相关性
·肿瘤内部含黏液细胞的比例>50%。
·较普通型预后较差。
·肿瘤结构模式变异类型:
(1)非特殊型:≥50%的肿瘤细胞含胞浆内黏液+普通型背景。
(2)肠型:≥50%的肿瘤细胞为杯状细胞+普通型/黏液型背景。
(3)印戒细胞型:≥50%的肿瘤细胞为印戒细胞+普通型背景。该型罕见,必须除外转移。
(4)浸润性复层产黏液的癌ISMC:复层上皮含有黏液,巢状浸润。该型预后差,P53可突变。
·鉴别:伴黏液分泌的子宫内膜样癌,转移癌。
·免疫与分子病理:P16+HPV检查阳性;ER、PR、vimentin、MUC6、GATA3和CK20通常阴性。
3、特殊的AIS
复层产黏液的上皮内病变(SMILE)的病理特征:非典型细胞核和胞浆内粘蛋白存在贯穿上皮的全层;弥漫性和强烈的p16染色。
[声明:本网站所有内容,凡未注明来源为“转载”,版权均归巢内网所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:巢内网”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们]


















